
【题目】T1 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O(g),发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1),下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 2.00 | 3.00 |
t1 | 0.80 | |
t2 | 1.80 |
A. 用H2表示反应在t1 min内的平均速率为v(H2)=0.60/t1mol·L-1·min-1
B. 保持其他条件不变,若起始时向容器中充入3.00 mol CO和2.00 mol H2O(g),达到平衡时,n(CO2)=1.20 mol
C. 保持其他条件不变,在t2 min时向容器中再通入1.00 mol CO,与原平衡相比,达到新平衡时CO转化率将增大
D. 温度升至T2 ℃,上述反应的平衡常数为0.70,则正反应的ΔH<0
【答案】C
【解析】
A.CO的物质的量的变化为(2.00-0.80)mol,反应在t1min内的平均速率为v(CO)=(2.00-0.80)mol ÷2L÷t1min =(0.60/t1)mol·L-1·min-1,根据反应速率之比等于化学计量数之比,t1min内H2的平均反应速率与CO的平均反应速率相同,故A正确;
B.根据t2>t1,对比表中数据可知t1 min时已经达到平衡状态,而反应物和生成物的化学计量数都为1,则其它条件不变,起始时向容器中充入的3.00 molCO和2.00 molH2O(g)与充入2.00molCO和3.00molH2O(g)达平衡时,反应的限度相同,故达到平衡时,n(CO2)=1.20 mol,故B正确;
C.增大反应物CO的浓度,平衡正向移动,CO转化率减小,水蒸气的转化率增大,故C错误;
D.T1℃时,该反应的平衡常数为K=(1.2/2)×(1.20/2)÷(0.80/2)×(1.80/2)=1,T2℃,上述反应的平衡常数为0.70,温度升高,平衡常数减小,平衡逆向移动,说明正反应为放热反应,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某班同学用如下实验探究其性质。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,配制成FeSO4溶液。在溶液中需加入少量铁屑,其目的是_____。
(2)甲组同学取2 mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为______。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeSO4溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_________。
(4)丙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeSO4溶液,溶液变成棕黄色,发生反应的离子方程式为________________
(5)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
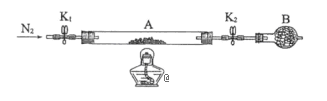
①仪器B的名称是______。
②将下列实验操作步骤正确排序_____(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_________(列式表示)。若实验时按a、d次序操作,则使x_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪(Sc2O3)的一种流程如下:

回答下列问题:
(l)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是__________。
(2)先加入氨水调节pH =3,过滤,滤渣主要成分是_______;再向滤液加入氨水调节pH=6,滤液中Sc3+的浓度为________。[己知:Ksp[Mn(OH)2]=1.9×10-13、Ksp[Fe(OH)3]=2.6×10-39,Ksp[Sc(OH)3]=9.0×10-31]
(3)用草酸“沉钪”。25℃时pH=2的草酸溶液中![]() =_______(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式_________。
=_______(保留两位有效数字)。写出“沉钪”得到草酸钪的离子方程式_________。
(已知Kal(H2C2O4)=5.9×10-2,Ka2(H2C2O4)=6.4×10-5)
(4)草酸钪“灼烧”氧化的化学方程式为_____________。
(5)废酸中含钪量为15mg/L,V L废酸最多可提取Sc2O3的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn (s、白)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH1
②Sn (s、灰)+2HCl (aq)=SnCl2 (aq)+H2 (g);DH2
③Sn (s、灰)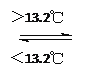 Sn (s、白);DH3=+2.1 kJ/mol
Sn (s、白);DH3=+2.1 kJ/mol
下列说法正确的是( )
A. DH1>DH2
B. 锡在常温下以灰锡状态存在
C. 灰锡转化为白锡的反应是放热反应
D. 锡制器皿长期处于低于13.2 ℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH30H(g),现在容积均为l L的a、b、c三个密闭容器中分别充入l molCO和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图l和图2所示。下列说法正确的是( )
CH30H(g),现在容积均为l L的a、b、c三个密闭容器中分别充入l molCO和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图l和图2所示。下列说法正确的是( )
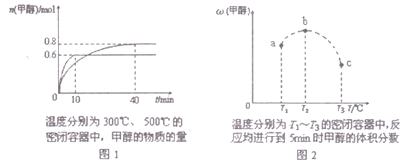
A. 该反应的正反应的△H>0
B. 升温或减压,可将b中的平衡状态转变成从c中的平衡状态
C. 反应进行到5min时,a容器中v(正)= v(逆)
D. 达到平衡时,a、b、c中CO转化率为b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种重要的化工原料,在生产和生活中应用十分广泛。
(1)Cl2可与NaOH溶液反应制取消毒液,请写出消毒液中有效成分的电子式__________。
(2)实验室可用MnO2和浓盐酸反应制取Cl2,反应的化学方程式是____________________。
(3)工业上可采取电解饱和食盐水的方法制取Cl2,阳极的电极反应式为________________。
(4)以HCl为原料,用O2氧化制取Cl2,可提高效益,减少污染。反应如下:4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
2Cl2(g) + 2H2O(g) H =-115.4 kJmol-1上述反应在同一反应器中,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。其基本原理如下图所示:
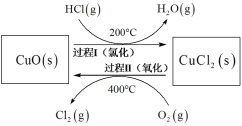
过程I的反应为:2HCl(g) + CuO (s) ![]() CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
CuCl2(s) + H2O(g) H1 =-120.4 kJmol-1
①过程II反应的热化学方程式为_______。
②过程I流出的气体通过稀NaOH溶液(含少量酚酞)进行检测,氯化初期主要为不含HCl的气体,判断氯化结束时溶液的现象为_______。
③相同条件下,若将氯化温度升高到300℃,溶液中出现上述现象的时间将缩短,其原因为_______。
④实验测得在不同压强下,总反应的HCl平衡转化率(ɑHCl)随温度变化的曲线如图:
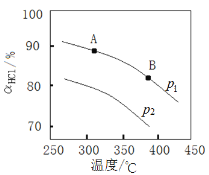
ⅰ.平衡常数比较:K(A)_____K(B) (填“>”“<”或“=”,下同)。
ⅱ.压强比较:p1_____ p2。
(5)以上三种制取Cl2的原理,其共同之处是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
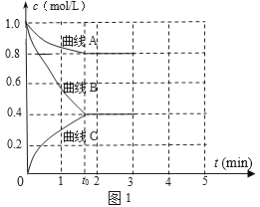
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
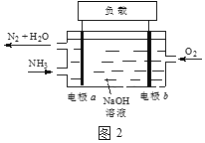
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ钠是一种活泼金属,能与很多物质反应,
(1)写出金属钠与水反应的化学方程式,并用双线桥标出电子转移的方向和数目__________________________________
(2)该反应的还原剂是_______,(填化学式,下同)
(3)该反应中被还原的元素是___________. (填元素符号),氧化产物是__________.
(4)若反应转移了0.4 mol电子,则产生的气体在标准状况下体积为____________L.
Ⅱ某研究小组同学为了探究硝酸的性质,进行了如下操作:
(1)从试剂柜里取一瓶浓硝酸,发现其保存在________色的试剂瓶里,原因是(用化学方程式表示)_________________________。打开瓶盖,小心地扇闻浓硝酸的气味。
(2)该研究小组欲用该浓硝酸(15 mol/L)来配制480mL 3 mol/L的稀硝酸,则需要量取的浓硝酸的体积是_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某粉末状样品由铁、铝、铜三种金属组成,加入过量稀硫酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
A. AlO2﹣ B. Fe2+ C. Fe3+ D. Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com