
【题目】室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:(已知lg4=0.6)
(1)a点溶液中pH约为________,此时溶液中H2O电离出的c(H+)为________。

(2)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用__________作指示剂,滴定终点在________(填“c点以上”或“c点以下”)。
(3)滴定过程中部分操作如下,下列各操作使测量结果偏高的是_________________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(4)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_____mol/L。
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
【答案】3.4 2.5×10-11mol/L c 酚酞 c点以上 A D 0.1050
【解析】
(1) 由K=c(H+) ×c(A-)/c(HA)= c2(H+)/0.1= 1.6×10-6,c2(H+)=1.6×10-7=16×10-8,c(H+)=4×10-4,pH=-lgc,(H+)=-lg(4×10-4)=4-0.6=3.4;酸抑制水电离,酸溶液中水电离产生的c(H+)为溶液中的氢氧根离子浓度,即c,(OH-)=KW/c,(H+)=10-14/4×10-4=2.5×10-11mol/L;综上所述,本题答案是:3.4 ,2.5×10-11mol/L。
(2)a点是HA溶液,b点是醋酸和少量KA的混合溶液,c点是KA和少量醋酸的混合溶液,d点是KA和KOH的混合溶液,酸、碱均能抑制水的电离,KA水解促进水的电离;所以c点溶液中水的电离程度最大;由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞;滴定终点应在c点以上;综上所述,本题答案是:c ,酚酞,c点以上。
(3)A.碱式滴定管未用标准碱溶液润洗就直接注入标准碱溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)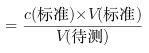 ,可以知道,测定c(HA)偏大,正确;
,可以知道,测定c(HA)偏大,正确;
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定,被滴定的HA溶质的量不变,对结果没有影响,错误;
C.滴定过程中,溶液出现变色后,立即停止滴定,相当于标准液的体积偏小,根据c(待测)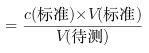 ,可以知道,测定c(HA)偏小,错误;
,可以知道,测定c(HA)偏小,错误;
D.滴定结束后,仰视液面,读取NaOH溶液体积,造成V(标准)偏大,根据c(待测)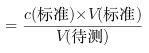 ,可以知道,测定c(HA)偏大,正确;
,可以知道,测定c(HA)偏大,正确;
综上所述,本题选A D。
(4)根据数据的有效性,舍去第3组数据,则1、2组平均消耗V(NaOH)=(21.01+20.99)/2=21.00mL,根据反应方程式HA+NaOH=NaA+H2O;0.021×0.1000=0.02×c(HA),则c( HA)=0.1050mol·L-1;综上所述,本题答案是:0.1050。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,能够判断一个反应是否是氧化还原反应的是
A.反应前后,元素是否有电子转移B.反应前后,元素是否有化合价变化
C.反应前后,是否有氧元素参加D.反应前后,是否有氢元素参加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丙烷可作为全身麻醉剂,环已烷是重要的有机溶剂,下面是部分环烷烃及烷烃衍生物的 结构简式、键线式和某些有机化合物的反应式(其中 Pt、Ni 是催化剂)。



回答下列问题:
(1)环烷烃与____________是同分异构体。
(2)从反应①~③可以看出,最容易发生开环加成反应的环烷烃是____________(填名称)。判断依 据为____________。
(3)环烷烃还可以与卤素单质,卤化氢发生类似的开环加成反应,如环丁烷与 HBr 在一定条件下反 应,其化学方程式为____________(不需注明反应条件)。
(4)写出鉴别环丙烷和丙烯的一种方法.试剂____________;现象与结论____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.22.4 L(标准状况)氩气含有的质子数为18NA
B.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA
C.标准状况下,2.24 L CCl4含有的氯原子数为0.4NA
D.1 L 0.1 mol·L-1硫酸钠溶液中含有的氧原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 0.5 mol Al与足量盐酸反应转移电子数为NA
B. 标准状况下,22.4 L氨气与22.4 L氮气所含原子数均为2NA
C. 58.5 g NaCl所含的离子数为2NA
D. 硫酸根离子的摩尔质量是98 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的图解表示构成细胞的元素、化合物及其作用,A.B.C.d代表不同的小分子物质,A.B.C代表不同的大分子物质,请分析回答下列问题。

(1)a是细胞生命活动所需要的主要能源物质,物质a是____,在动物细胞内,与物质A作用最相近的物质是____。若物质A在动物、植物细胞中均可含有,并且作为细胞内最理想的储能物质,则A是_________。
(2)图中的物质b是____,其分子结构的特点是______________,物质c在人体细胞中共有____种。若B.C构成了细胞膜的基本结构,则B.C分别是____。
(3)物质d是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的或者实验操作不正确的是 ( )
A. 定容 B. 比较硫、碳、硅三种元素的非金属性
B. 比较硫、碳、硅三种元素的非金属性 C. 尾气处理
C. 尾气处理 D. 测定黄铜中锌的含量
D. 测定黄铜中锌的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能复合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1 = -aKJ/mol
C8H18(1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH2= -bKJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式_________________________________。
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
CH3OH(g)+H2O(g) △H= — 53.7kJ·mol-1 平衡常数K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
CO(g)+H2O(g) △H= + 41.2kJ·mol-1 平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应△H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)。
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 70.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
CH3OH(g)。在体积均为2L的三个恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。下图为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。
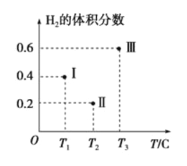
①0~5min时间内容器Ⅱ中用CH3OH表示的化学反应速率为_________________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学科学的应用叙述不正确的是( )
A.化学科学将继续推动材料科学的发展
B.化学科学将为环境问题的解决提供有力的保障
C.化学科学在了解疾病的病理方面无能为力
D.化学科学使人类能够更好地利用能源和资源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com