
| A. | 1 mol甲醇分子中含有的共价键数为4 NA | |
| B. | 7.8g Na2O2固体与水完全反应时,转移的电子数为0.1NA | |
| C. | 标准状况下,11.2 L水中含有的氧原子数为0.5 NA | |
| D. | 1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-数为0.5 NA |
分析 A.1mol甲醇分子中含有3mol碳氢键、1mol碳氧键和1mol氧氢键,总共含有5mol共价键;
B.根据n=$\frac{m}{M}$计算出过氧化钠的质量,然后可得出生成氧气的物质的量,再结合过氧化钠中氧元素的化合价为-1价计算转移电子数;
C.标准状况下水的状态不是气态;
D.醋酸为弱酸,在溶液中不能部分电离出醋酸根离子.
解答 解:A.甲醇分子中含有3个碳氢键、1个碳氧键和1个氧氢键,所以1mol甲醇中含有5mol共价键,含有的共价键数目为5NA,故A错误;
B.7.8g过氧化钠的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,0.1mol过氧化钠与水完全反应生成0.05mol氧气,转移电子的物质的量为:0.05mol×2=0.1mol,转移的电子数为0.1NA,故B正确;
C.标准状况下水不是气体,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.1 L 0.5 mol/L CH3COONa溶液中含有0.5mol醋酸,由于醋酸部分电离出醋酸根离子,则溶液中含有的CH3COO-数小于0.5 NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,C为易错点,注意明确标准状况下气体摩尔体积的使用条件.


科目:高中化学 来源: 题型:选择题
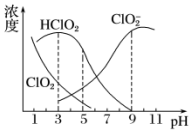 亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka约为10-6 | |
| C. | 使用该漂白剂的最佳pH为3 | |
| D. | ClO2可用于自来水的消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学式为Na2CO3 | B. | 受热不分解 | C. | 属于盐 | D. | 与盐酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事实 | 推测 |
| A. | Na与冷水反应剧烈,K与冷水反应更剧烈 | Li与冷水反应缓慢 |
| B. | 20Ca(OH)2碱性强于12Mg(OH)2 | 38Sr(OH)2碱性强于20Ca(OH)2 |
| C. | Si是半导体材料,同主族的Ge也是半导体材料 | 第ⅣA元素形成的单质都是半导体材料 |
| D. | F2与H2在暗处剧烈化合,Cl2与H2光照或点燃时反应 | Br2与H2反应需要加热到一定温度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英是制造光导纤维的原料,也是常用的半导体材料 | |
| B. | 氧化铝是冶炼金属铝的原料,也是较好的耐火材料 | |
| C. | 与铜质水龙头的钢质水管,在连接处易发生腐蚀 | |
| D. | 大量燃烧化石燃料是造成雾霾的重要因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | a中物质 | b中现象 | 结论或解释 | |
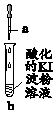 | A. | Fe(OH)3悬浊液 | Fe(OH)3悬浊液溶解,溶液变蓝 | 发生反应:2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2 |
| B. | NaClO3溶液 | 先变蓝后褪色 | 褪色的反应:2ClO3-+10I-+12H+═Cl2+5I2+6H2O | |
| C. | \ | 空气中放置一段时间,溶液变蓝 | 发生反应:4I-+4H++O2=2I2+2H2O | |
| D. | 含碘元素的无色溶液 | 溶液呈蓝色 | 可能发生的反应:5I-+IO3-+6H+=3I2+3H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | 只有⑤ | C. | 只有① | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com