
【题目】物质的量浓度均为![]() 的下列电解质溶液各取10mL混合后,pH小于7的是
的下列电解质溶液各取10mL混合后,pH小于7的是![]()
A.![]() 、
、![]() B.
B.![]() 、
、![]()
C.![]() 、
、![]() D.NaOH、
D.NaOH、![]()
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】已知室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,下列叙述不正确的是
发生电离,下列叙述不正确的是![]()
①该溶液的![]() ;
;
②升高温度,溶液的pH增大;
③此酸的电离平衡常数约为![]() ;
;
④加水稀释后,各离子的浓度均减小;
⑤由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍;
倍;
⑥适当增大HA的浓度,HA的电离平衡正向移动,电离平衡常数增大。
A.②④⑥B.①④⑤C.②⑤⑥D.②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分。已知a原子的最外层电子数比次外层电子数少3,下列说法中不正确的是
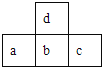
A. 元素c的含氧酸一定是强酸
B. 元素a、d的原子半径:a>d
C. 元素b在自然界中存在游离态
D. 元素b、c的阴离子半径:b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列叙述正确的是![]()
A.![]() 的
的![]() 与
与![]() 混合溶液中
混合溶液中![]()
B.![]() 的可乐中
的可乐中![]() 是
是![]() 的柠檬水中
的柠檬水中![]() 的10倍
的10倍
C.AgCl在![]()
![]() 溶液和
溶液和![]() NaCl溶液中的溶解度相同
NaCl溶液中的溶解度相同
D.![]() 溶液加水稀释至100mL,pH和
溶液加水稀释至100mL,pH和![]() 均减小
均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____.
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____,B原子的杂化轨道类型是_____.
Li、B、H元素的电负性由大到小排列顺序为_____.
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
I1/kJmol﹣1 | I2/kJmol﹣1 | I3/kJmol﹣1 | I4/kJmol﹣1 | I5/kJmol﹣1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____(填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____,NaH的理论密度是___________gcm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苯甲酯是一种难溶于水,密度大于水的无色油状液体,具有茉莉花气味,可用做调香剂。
(一)以乙烯,甲苯为原料,合成乙苯甲酯的路线如图所示。

(1)写出由乙烯制备A的化学方程式______。
(2)写出生成乙酸苯甲酯的化学方程式______。
(3)C到苯甲醇的反应类型______。
(二)制备乙酸苯甲酯的流程如图:
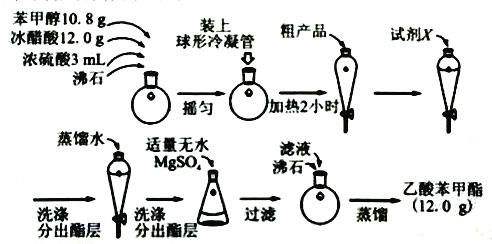
(4)球形冷凝管的作用为______。
(5)试剂X可为______。
A.氢氧化钠溶液 B.碳酸钠溶液 C.乙醇 D.氯化钠溶液
(6)分出酯层时应收集______层液体(填“上”或“下”)
(7)无水MgSO4的作用为______。
(8)本实验所得乙酸苯甲酯的产率为______。(已知:相对分子量:苯甲醇:108;乙酸:60;乙酸苯甲酯:150)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三元羧酸H3A在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向10mL0.01mol·L-1的H3A溶液中滴入0.01mol·L-1的NaOH溶液,H3A、H2A-、HA2-、A3-的物质的量分数与溶液的pH的关系如图所示。则下列说法中错误的是( )

A.常温时,0.01mol·L-1的H3A溶液的pH介于2~3之间
B.常温时,反应A3-+H2O ![]() HA2-+OH-的平衡常数为K=10c-14
HA2-+OH-的平衡常数为K=10c-14
C.若b=7,则将等物质的量的NaH2A与Na2HA加入到适量蒸馏水中使其完全溶解,则所得的溶液的pH一定等于7
D.加入NaOH溶液的体积为30mL时,所得溶液中存在有:c(OH-)=3c(H3A)+2c(H2A-)+c(HA2-)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2等有毒气体会危害人体健康,破坏环境,对其进行无害处理研究一直是科技界关注的重点。请回答以下问题:
(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) ΔH1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) ΔH2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) ΔH3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式__。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随
N2(g)+2CO2(g) ΔH=-759.8kJ·mol-1,若反应达到平衡时,所得的混合气体中含N2的体积分数随![]() 的变化曲线如图1。
的变化曲线如图1。

①a、b、c、d四点的平衡常数从大到小的顺序为__。
②若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极的电极反应式为__,经过一段时间后,若乙中需加0.1molCu2(OH)2CO3可使溶液复原,则转移的电子数为__NA。
(4)常温下,SO2可以用碱溶液吸收处理。若将SO2通入到NaOH溶液中,充分反应后得到amol·L-1的NaHSO3溶液,该溶液的pH=5,则该溶液中c(SO32-)___c(H2SO3)(填“>”、“=”或“<”),HSO3-的电离常数约为___(用含a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.保存氯化亚铁溶液时,在溶液中加入少量稀盐酸,以防止Fe2+水解
B.同温时,等浓度的NaHCO3和Na2CO3溶液, Na2CO3溶液的pH大
C.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
D.加热CH3COONa溶液,溶液中![]() 的值将减小
的值将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com