
【题目】已知室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,下列叙述不正确的是
发生电离,下列叙述不正确的是![]()
①该溶液的![]() ;
;
②升高温度,溶液的pH增大;
③此酸的电离平衡常数约为![]() ;
;
④加水稀释后,各离子的浓度均减小;
⑤由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍;
倍;
⑥适当增大HA的浓度,HA的电离平衡正向移动,电离平衡常数增大。
A.②④⑥B.①④⑤C.②⑤⑥D.②④⑤
【答案】A
【解析】
室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,该溶液中
发生电离,该溶液中![]() ,
,
![]() 该溶液的
该溶液的![]() ;
;
![]() 升高温度,促进HA电离;
升高温度,促进HA电离;
![]() 此酸的电离平衡常数
此酸的电离平衡常数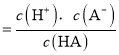 ;
;
![]() 加水稀释后,溶液中
加水稀释后,溶液中![]() 增大;
增大;
![]() 该溶液中水电离出的
该溶液中水电离出的![]() ;
;
![]() 电离平衡常数只与温度有关,温度不变,电离平衡常数不变。
电离平衡常数只与温度有关,温度不变,电离平衡常数不变。
室温时,![]() 某一元酸HA在水中有
某一元酸HA在水中有![]() 发生电离,该溶液中
发生电离,该溶液中![]() ,
,
![]() 该溶液的
该溶液的![]() ,故正确;
,故正确;
![]() 升高温度,促进HA电离,则溶液中
升高温度,促进HA电离,则溶液中![]() 增大,溶液在pH减小,故错误;
增大,溶液在pH减小,故错误;
![]() 此酸的电离平衡常数
此酸的电离平衡常数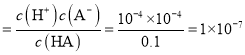 ,故正确;
,故正确;
![]() 加水稀释后,促进HA电离,HA电离增大程度小于溶液体积增大程度,则溶液中
加水稀释后,促进HA电离,HA电离增大程度小于溶液体积增大程度,则溶液中![]() 减小,温度不变水的离子积常数不变,则溶液中
减小,温度不变水的离子积常数不变,则溶液中![]() 增大,故错误;
增大,故错误;
![]() 该溶液中水电离出的
该溶液中水电离出的![]() ,溶液中
,溶液中![]() ,所以由HA电离出的
,所以由HA电离出的![]() 约为水电离出的
约为水电离出的![]() 的
的![]() 倍,故正确;
倍,故正确;
![]() 电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故错误;
电离平衡常数只与温度有关,温度不变,电离平衡常数不变,故错误;
故选A。


 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应热就是反应中放出的能量
B.在任何条件下,化学反应的焓变都等于化学反应的反应热
C.由![]() (s,石墨)═
(s,石墨)═![]() (s,金刚石)
(s,金刚石) ![]() 可知,金刚石比石墨稳定
可知,金刚石比石墨稳定
D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3X(g)+Y(g) ![]() 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的速率v为
A. v (X)=0.05mol·L-1·min-1B. v (Z)= 0.10mol·L-1·min-1
C. v (Y)=0.10mol·L-1·min-1D. v (W)=0.05mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂每小时生产a 吨98%(质量分数)硫酸。为使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求燃烧后的混合气体中含氧气的体积分数为b%。若空气中氧气的体积分数为21%,且不考虑各生产阶段的物料损失,则
(1)该厂每小时消耗标准状况下空气的体积为___________m3。
(2)为满足题设要求,b%的下限等于___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
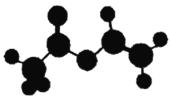
A.该化合物的名称为乙酸乙酯
B.该化合物与![]() 的四氯化碳溶液不反应
的四氯化碳溶液不反应
C.该化合物既能发生水解反应,又能发生缩聚反应
D.该化合物的链状同分异构体中,能与![]() 反应放出
反应放出![]() 的只有3种
的只有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离常数如图两条曲线所示,曲线中的点都符合![]() 常数,下列说法错误的是
常数,下列说法错误的是![]()
![]()

A.图中温度![]()
B.图中五点![]() 间的关系:
间的关系:![]()
C.曲线a、b均代表纯水的电离情况
D.若处在B点时,将![]() 的硫酸溶液与
的硫酸溶液与![]() 的KOH溶液等体积混合后,溶液显碱性
的KOH溶液等体积混合后,溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在298K、100 kPa时,已知:①2H2O(g)![]() O2(g)+2H2(g) △H1 K1
O2(g)+2H2(g) △H1 K1
②Cl2(g)+H2(g) ![]() 2HCl(g) △H2 K2
2HCl(g) △H2 K2
③2Cl2(g)+2H2O(g![]() 4HCl(g)+O2(g) △H3 K3
4HCl(g)+O2(g) △H3 K3
则△H1、△H2、△H3间的关系是_________,K1、K2、K3间的关系是___________。
II.高温下,炼铁高炉中存在下列平衡:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。试回答下列问题:
Fe(s)+CO2(g) △H>0。试回答下列问题:
(1)写出该反应的平衡常数表达式________。
(2)升高温度,该反应的平衡常数K值将________(填“增大”、“减小”、“不变”),平衡体系中固体的质量将________填“增大”、“减小”、“不变”)。
(3)已知1100℃时该反应的平衡常数K=0.263。在该温度测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,此时该化学反应的速度是v(正)______ v(逆)(填”>”、“<”、“=”),原因是________。
(4)保持高炉温度为1100 ℃,向高炉中补充大量的空气,重新达到平衡后,该反应的平衡常数K值________0.263(填”>”、“<”、“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,c(CH3COOH)+ c(CH3COO-)=0.1mol/L的醋酸、醋酸钠混合溶液中,c(CH3COOH)、 c(CH3COO-)与pH的关系如图所示。下列有关该溶液的叙述不正确的是
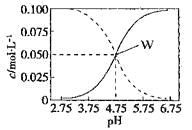
A.pH=4的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
B.W点所表示的溶液中:c(Na+)+ c(H+)= c(CH3COOH)+c(OH-)
C.将W点所表示的1.0L溶液稀释到10L,用pH计测量,溶液的pH应为5.75
D.pH=5.5的溶液中:c(Na+)+ c(H+)- c(OH-)+c(CH3COOH)=0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com