
CO、O2、CO2混合气体9mL电火花引爆后,恢复到原来状态时,气体体积减少1mL,通过NaOH溶液后,体积又减少5mL,则混合气体中CO、O2、CO2体积比可能为 ___ __ 。
2:4:3或5:1:3(每空3分)
解析试题分析:一氧化碳和氧气生成二氧化碳,最后气体的体积=(9-1-5)=3mL,说明有气体剩余,剩余的气体是氧气或者一氧化碳.设参加反应的一氧化碳和氧气的体积分别X、Y,利用体积差量可得:
2CO + O2 = 2CO2 ?V
2 1 2 1
X Y 1mL
可得X=2mL,Y=1mL即参加反应的一氧化碳的体积是2mL,氧气的体积是1mL.
如果剩余的气体是一氧化碳,则混合气体中各种气体的体积分别是:氧气的体积1mL,一氧化碳的体积=(2+3)=5mL,二氧化碳的体积=(9-1-5)=3mL.所以混合气体中一氧化碳、氧气、二氧化碳的体积比是5:1:3。
② 如果剩余的气体是氧气,则混合气体中各种气体的体积分别是:氧气的体积=(1+3)=4mL,一氧化碳的体积=2mL,二氧化碳的体积=(9-2-)=3mL.所以混合气体中一氧化碳、氧气、二氧化碳的体积比是2:4:3。
考点:本题考查气体体积的计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
过氧化氢溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是 (填代号)。
A.Na2O2+2HCl 2NaCl+H2O2 2NaCl+H2O2 |
B.Ag2O+H2O2 2Ag+O2↑+H2O 2Ag+O2↑+H2O |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.3H2O2+Cr2(SO4)3+10KOH 2K2CrO4+3K2SO4+8H2O 2K2CrO4+3K2SO4+8H2O |

 A+NH3↑,试指出生成物A的化学式为 。
A+NH3↑,试指出生成物A的化学式为 。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度为 mol?L-1;
(2)在标准状况下产生气体的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室配制480 mL 0.1mol·L-1 NaOH溶液,回答下列问题
(1)应用托盘天平称取氢氧化钠固体 g。
(2)配制NaOH溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒 、 。
使用容量瓶前必须进行的操作是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)定容时若加水超过刻度线,应如何处理? 。
(5)试分析下列操作对所配溶液的浓度有何影响。
A. 偏高 B. 偏低 C.不变(用符号回答)
① 定容时俯视刻度线 ;
② 放在滤纸上称量NaOH固体 。
③容量瓶没有干燥,有少量蒸馏水: 。
④定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度: 。
(6)请你帮助把试剂瓶(盛放上述配制好的溶液)上标签的内容填上去 (标签如图)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)0.5molCH4的质量是 g,在标准状况下的体积为 L;含 有约 个氢原子。
将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为 ;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)将ag氯化钙溶于1.8L水中,恰好使钙离子数与水分子数之比为1:100,则a值为 。
(2)在反应2A+B=3C+2D中,已知3.4gA与3.2gB完全反应,生成4.8gC,又知道D的式量为18,则B的式量是
(3)25.4g 某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是 ;ACl2的化学式是 。
(4) 某混合物由Na2SO4、Al2(SO4)3组成,已知Na、Al两元素的质量之比为23: 9,则Na2SO4和Al2(SO4)3物质的量之比为 ,含1.00mol SO42–的该混合物的质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)3.01×1022个OH- 的物质的量为________,质量为________,含有质子的物质的量为________,含有电子的物质的量为________。
(2)相同状况下,10mL X2气体与30mL Y2气体化合生成20mL C气体,则C的化学式为_________。
(3)某地酸雨经检验,除含氢离子外,还有如下离子:c(Na+)=1.4×10-3 mol·L-1 ,
c(Cl- ) =3.5×10-3 mol·L-1,c(NH4+) =2.3×10-3 mol·L-1, c(SO42-) =1.5×10-3
mol·L-1。则该溶液中氢离子的浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要 CH4___m3 (标准状况)。
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________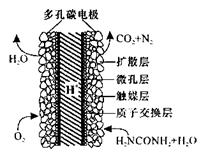
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com