
【题目】实验室有NH4HCO3和NaHSO3的混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。 (已知酸性KMnO4被SO2还原的反应原理:SO2+MnO4-+H2O→SO42-+Mn2++H+)回答以下问题:
(1)化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
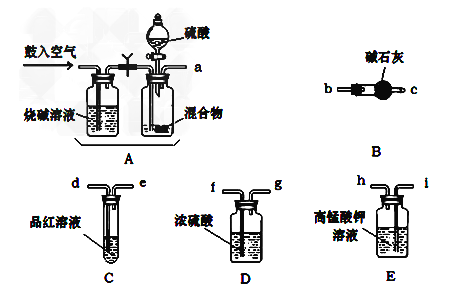
(1)请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b…)
a→→_________________________________________。
(2)实验过程中空气的鼓入需要分2次,第一次鼓入空气的作用是_______________;
(3)C装置的作用是_________________。
(4)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为____________。
(5)从定量测定的准确性考虑,该套装置还应作进一步的改进是_____________。
【答案】 a→i→h→d→e→f→g→b→c 排空装置中的空气或CO2 检查SO2是否除尽 60.3% 在B之后再接一个阻止空气中水和二氧化碳进入B的装置
【解析】(1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,接着将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量.所以装置连接顺序是aihdefgbc;(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置,故答案为:排出装置中原有空气;将生成的气体全部送入后续装置;(3)高锰酸钾溶液的作用是吸收二氧化硫气体,防止二氧化硫对测定结果的影响,需要经C检查SO2是否除尽,防止二氧化硫对测定结果的影响;(4)碱石灰增重4.4g,即二氧化碳物质的量为0.1mol,由碳元素守恒,碳酸氢铵物质的量也为0.1mol,碳酸氢铵质量为7.9g,NH4HCO3的质量分数为7.9g/13.1g%=60.3%,故答案为:60.3%.(5)碱石灰与大气相通,碱石灰能吸收空气中的二氧化碳和水蒸气,所以应在碱石灰后面再连接一个装有碱石灰的装置。


科目:高中化学 来源: 题型:
【题目】某同学用如图所示装置图制取并收集干燥的氯气. 
回答下列问题:
(1)装置C的作用是 , 装置D的作用是 .
(2)装置F的作用是 .
(3)装置B中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl 的 物质的量为 .
(4)写出圆底烧瓶中发生的化学方程式: .
(5)F处发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KCl、MgCl2、Mg(NO3)2形成的混合溶液中,c(K+)=0.1mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.2mol/L,则c(NO3-)为 :
A. 0.15 mol/L
B. 0.20 mol/L
C. 0.25 mol/L
D. 0.40 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列反应:①NH4HCO3溶液与石灰水反应、②K2SO3溶液与稀盐酸反应,③Si与烧碱溶液反应、④Fe与稀硝酸反应,改变反应物用量,不能用同一个离子方程式表示的是( )。
A. ①②③ B. ①②④
C. ①③④ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯酸镁常用作催熟剂、除草剂等,实验室制备Mg(ClO3)2·6H2O的流程如下:

已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。

(1)加入NaClO3饱和溶液后发生反应的化学方程式为_______________,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为:①_________;_____________;洗涤;②将滤液冷却结晶;③过滤、洗涤。
(2)产品中Mg(ClO3)2·6H2O含量的测定:(已知Mg(ClO3)2·6H2O的摩尔质量为299 g/mol)
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2:取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20 .00 mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100 mol/L K2Cr2O7溶液滴定剩余的Fe2+至终点。反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式____________________;
②产品中Mg(ClO3)2·6H2O的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3.01×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A. 8g /mol B. 32g
C. 64g /mol D. 16g /mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为验证元素周期表中元素性质的递变规律,利用如图装置可验证同主族非金属性的变化规律.设计了如下系列实验. 
(1)向Na2S溶液中通入氯气出现淡黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)仪器A的名称为 ,
(3)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到混合溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(4)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3 , C中加Na2SiO3溶液观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,应用溶液除去.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com