
【题目】某同学用如图所示装置图制取并收集干燥的氯气. 
回答下列问题:
(1)装置C的作用是 , 装置D的作用是 .
(2)装置F的作用是 .
(3)装置B中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl 的 物质的量为 .
(4)写出圆底烧瓶中发生的化学方程式: .
(5)F处发生反应的离子方程式为 .
【答案】
(1)除去氯气中的氯化氢;干燥氯气
(2)尾气处理防止氯气污染空气
(3)0.2mol
(4)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(5)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
【解析】解:(1)因为浓盐酸具有挥发性,所以制取的氯气中含有氯化氢、水蒸气,氯气在饱和食盐水中溶解度很小,氯化氢易溶于水,所以利用氯化钠饱和溶液吸收氯气中的氯化氢,浓硫酸具有吸水性,所以装置D作用:干燥氯气;所以答案是:除去氯气中的氯化氢;干燥氯气;(2)氯气有毒,直接排放能够引起空气污染,氯气能够与氢氧化钠反应,可以用盛有氢氧化钠溶液的F吸收过量的氯气;所以答案是:尾气处理防止氯气污染空气;(3)装置B中,如果反应产生氯气的体积为2.24L(标准状况),其物质的量= ![]() =0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,所以答案是:0.2mol;(4)圆底烧瓶中浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,离子方程式MnO2+4HCl(浓)
=0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,所以答案是:0.2mol;(4)圆底烧瓶中浓盐酸与二氧化锰在加热条件下反应生成氯气、氯化锰和水,离子方程式MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;所以答案是:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(5)F中氢氧化钠与氯气反应生成氯化钠和次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
MnCl2+Cl2↑+2H2O;(5)F中氢氧化钠与氯气反应生成氯化钠和次氯酸钠和水,离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O.
【考点精析】关于本题考查的氯气的实验室制法,需要了解实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】下列有关文献记载中涉及的化学知识表述不正确的是
A. “以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B. “煤饼烧蛎房成灰(蛎房即牡蛎壳)”中灰的主要成分为氧化钙
C. “丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D. “墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol乙烯与氯气发生完全加成反应,然后使该加成产物与氯气在光照条件下发生完全取代反应,则两个过程中消耗氯气的总物质的量是( )
A.3 mol B.4 mol C.5 mol D.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中均需要的仪器是( )
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A. 试管 B. 胶头滴管
C. 玻璃棒 D. 漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确量取25.00 mL酸性高锰酸钾溶液,可选用的仪器是( )
A.500 mL量筒B.10 mL量筒C.50 mL酸式滴定管D.50 mL碱式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有NH4HCO3和NaHSO3的混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。 (已知酸性KMnO4被SO2还原的反应原理:SO2+MnO4-+H2O→SO42-+Mn2++H+)回答以下问题:
(1)化学小组主要选用了下列药品和仪器进行实验。(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
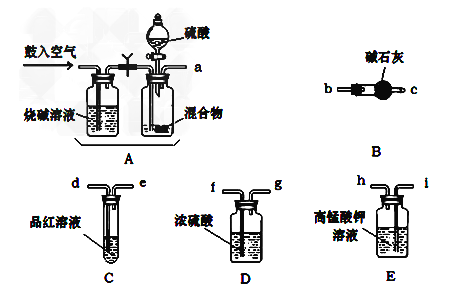
(1)请按气流由左向右的方向,仪器连接顺序是(填仪器的接口字母a、b…)
a→→_________________________________________。
(2)实验过程中空气的鼓入需要分2次,第一次鼓入空气的作用是_______________;
(3)C装置的作用是_________________。
(4)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为____________。
(5)从定量测定的准确性考虑,该套装置还应作进一步的改进是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com