
 ①图中电解质溶液为硫酸铜溶液,则Fe电极是
①图中电解质溶液为硫酸铜溶液,则Fe电极是
| ||
| ||
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 (1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:
(1)(2011?江苏高考,节选)Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式:| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| △ |
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
| O | - 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
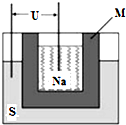 化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
化学反应在工农业生产中有着重要的应用.按要求回答下列问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
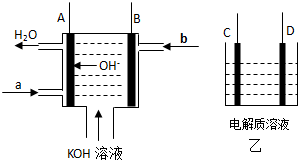
(12分)如图甲为氢氧燃料电池装置示意图(已标明电池工作时OH-的移动方向),A、B、C、D为电极。
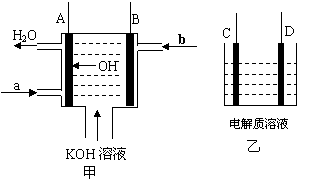 |
(1)若A、B连接外电阻并形成回路,则A电极的电极反应式 ▲ ,b处通入的气体
为 ▲ 。若乙中C为Fe、D石墨,电解质为NaCl,则导线连接C、D后,D电极
的电极反应式 ▲ 。
(2)若乙中C、D均为石墨,电解质溶液为滴有酚酞的NaCl溶液,用导线将A与D相连、
B与C相连,则一段时间后 ▲ 极附近的溶液呈红色,乙中总反应的化学方程式为 ▲_。
(3) 若乙中C为粗铜、D为纯铜片,电解质溶液为硫酸酸化的硫酸铜溶液,用导线将A与
D相连、B与C相连,则乙中D电极的电极反应式 ▲ 。当甲中b气体消耗0.1 mol
时,理论上乙中某电极增重 ▲ g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com