
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t ℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=。
(2)该反应为(填“吸热”或“放热”)反应。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是____。
(2)以铝土矿(主要成分为Al2O3.含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下(已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀)。

①实验前,要将铝土矿粉粹的目的是_______。
②用氧化物的形式表示铝硅酸钠的化学式________。
③步骤②涉及到的离子方程式是: _______。
④写出利用Al2O3制备金属Al的化学方程式: _______。
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)N2和H2反应生成34g NH3 , 放出92kJ热量。
(2)1molCH4(g)在O2中完全燃烧生成CO2和H2O(g),放出890.3kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
Ⅰ.以H2O2的分解反应为研究对象,实验方案与数据记录如下表,t表示收集a mL O2所需的时间。
序号 | 反应 温度/℃ | c(H2O2)/ mol·L-1 | V(H2O2) /mL | m(MnO2) /g | t/min |
1 | 20 | 2 | 10 | 0 | t1 |
2 | 20 | 2 | 10 | 0.1 | t2 |
3 | 20 | 4 | 10 | 0.1 | t3 |
4 | 40 | 2 | 10 | 0.1 | t4 |
(1)设计实验2和实验3的目的是研究____________对化学反应速率的影响。
(2)为研究温度对化学反应速率的影响,可以将实验________和实验________作对比(填序号)。
(3)将实验1和实验2作对比,t1________t2(填“>”、“<”或“=”)。
Ⅱ.以KI和FeCl3反应为例(2Fe3++2I-![]() 2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
2Fe2++I2)设计实验,探究此反应存在一定的限度。可选试剂:
①0.1 mol·L-1 KI溶液 ②0.1 mol·L-1 FeCl3溶液 ③0.1 mol·L-1 FeCl2溶液 ④0.1 mol·L-1 盐酸 ⑤0.1 mol·L-1 KSCN溶液 ⑥CCl4
实验步骤:(1)取5 mL 0.1 mol·L-1 KI溶液,再滴加几滴0.1 mol·L-1 FeCl3溶液;
(2)充分反应后,将溶液分成三份;
(3)取其中一份,加试剂⑥,振荡,CCl4层显紫色,说明反应生成碘;
(4)另取一份,加试剂________(填序号),现象______________,说明此反应存在一定的限度。
Ⅲ.N2O4可分解为NO2。在100 mL密闭容器中投入0.01 mol N2O4,利用现代化学实验技术跟踪测量c(NO2)。c(NO2)随时间变化的数据记录如下图所示。
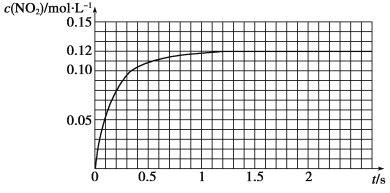
(1)反应容器中最后剩余的物质有______________,其中N2O4的物质的量为________mol。
(2)c(NO2)随时间变化的曲线表明,实验测得的化学反应速率在逐渐减小,最后________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对1mol H2O的说法正确的是( )
A.含有6.02×1023个氢分子B.含有6.02×2×1023个氢元素
C.质量为18gD.氢原子与氧原子的质量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS 等)制备钼酸钠晶体的部分流程如下:
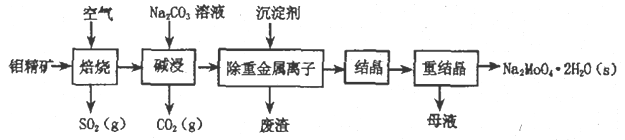
(1)Na2MoO4·2H2O 中钼元素的化合价为____________;焙烧时为了使钼精矿充分反应,可采取的措施是______________(答出一条即可)。
(2)写出焙烧附生成MoO3 的化学方程式为:_________________。
(3)写出“碱浸”反应的离子方程式:____________________。
(4)下图是碳钢在3 种不同介质中的腐蚀速率实验结果:
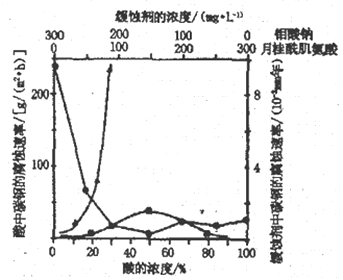

①当硫酸的浓度大于90%时,腐蚀速率几率为零,原因是__________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3 保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是_________________。
③要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为_______________。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:______________________。
Lix(MoS2)n。则电池放电时的正极反应式是:______________________。
(6)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时,SO42-的去除率是__________。[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.0×10-10,Ksp(BaMoO4)=40×10-8加入Ba(OH)2固体引起的溶液体积变化可忽略。]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应2C(g) ![]() A(g)+2B(g),已知△H<0,下列判断正确的是( )
A(g)+2B(g),已知△H<0,下列判断正确的是( )
A.仅常温下反应可以自发进行
B.仅高温下反应可以自发进行
C.任何温度下反应均可以自发进行
D.任何温度下反应均难以自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。( )
HIn(溶液) ![]() H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是
A.①③⑤
B.②⑤⑥
C.①④
D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N≡N键能为946 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2 ![]() 2NH3 ΔH=-92 KJ/mol,则H—H键的键能是
2NH3 ΔH=-92 KJ/mol,则H—H键的键能是
A. < 436 KJ/mol B. 436 KJ/mol C. 497 KJ/mol D. 467 KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com