
反应4A(s)+3B(g)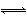 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 mol·L-1·s-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
D.在这2 min内用B和C表示的反应速率的值都是相同的
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源:2014年高二化学苏教版选修2 1专题综合检测练习卷(解析版) 题型:选择题
下列方法适宜于软化永久硬水的是( )。
A.离子交换法 B.长时间加热
C.加入Na2SO4 D.加入AgNO3
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 7化学平衡状态的建立及标志练习卷(解析版) 题型:选择题
一定条件下,发生如下反应:2A(g)+2B(g)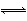 3C(g)+ D(g)在容积不变的密闭容器中进行,达到化学平衡状态的标志是( )
3C(g)+ D(g)在容积不变的密闭容器中进行,达到化学平衡状态的标志是( )
A.单位时间内生成n mol B,同时消耗3n mol C
B.容器内压强不随时间而变化
C.混合气体的密度不随时间变化
D.单位时间内生成2n mol A,同时生成n mol D
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 6影响化学反应速率的因素练习卷(解析版) 题型:选择题
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入H2O(g)使体系压强增大
D.保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 5化学反应速率练习卷(解析版) 题型:选择题
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2 2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)=0.4 mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
A.等于1.6 molB.等于1.2 molC.大于1.6 molD.小于1.2 mol
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:填空题
把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g) CO2(g) ΔH1<0①
CO2(g) ΔH1<0①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g) CO(g)+H2(g) ΔH2>0②
CO(g)+H2(g) ΔH2>0②
再燃烧水煤气:
2CO(g)+O2(g) 2CO2(g) ΔH3<0③
2CO2(g) ΔH3<0③
2H2(g)+O2(g) 2H2O(g) ΔH4<0④
2H2O(g) ΔH4<0④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是 。
(3)已知:①C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1
CO2(g) ΔH1=-393.5 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③TiO2(s)+2Cl2(g) TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
TiCl4(s)+O2(g) ΔH3=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s) TiCl4(s)+2CO(g)的ΔH= 。
TiCl4(s)+2CO(g)的ΔH= 。
(4)已知下列各组热化学方程式
①Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
3FeO(s)+CO2(g) ΔH3=+640 kJ·mol-1
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 ______________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:选择题
下列关于反应热的说法正确的是( )
A.当ΔH为“-”时,表示该反应为吸热反应
B.已知C(s)+O2(g) CO(g)的反应热为-110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1
CO(g)的反应热为-110.5 kJ·mol-1,说明碳的燃烧热为110.5 kJ·mol-1
C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(解析版) 题型:选择题
用50 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1 NaOH溶液反应,实验中测得起始温度为20.1 ℃,终止温度为23.4 ℃,反应后溶液的比热容为4.18 J·g-1·℃-1,盐酸和NaOH溶液的密度都近似认为是1 g·cm-3,则中和反应生成1 mol 水时放热( )
A.55.2 kJB.391 kJC.336 kJD.1.38 kJ
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(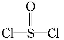 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com