
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)
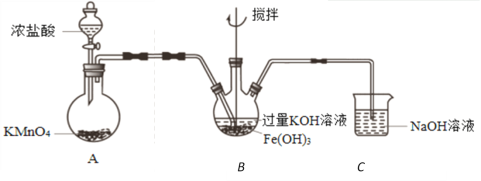
①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和![]() 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。
【答案】K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质 2KMnO4+16HCl(浓)=2MnCl2+2KCl +5Cl2↑+8H2O 应该增加盛装饱和食盐水的洗气瓶,吸收蒸发出来的HCl气体 Cl2+2OH=Cl+ClO+H2O Fe3+ 4FeO42+20 H+=4Fe3++3O2↑+10H2O 排除ClO的干扰 溶液的酸碱性不同
【解析】
(1)K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,说明K2FeO4具有强氧化性,而FeO42被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质,所以可以用来净水;
(2)本实验采用氯气与氢氧化铁在碱性条件下制备K2FeO4,而采用浓盐酸与高锰酸钾溶液反应制备的氯气中混有氯化氢杂质,应先除去;
(3)通过Cl2、Fe(OH)3与KOH之间的反应制备K2FeO4,溶液中可能存在副反应Cl2+2OH=Cl+ClO+H2O,因此制备出的K2FeO4中可能混有次氯酸钾和氯化钾等杂质。
方案I,取少量a,滴加KSCN溶液至过量,溶液呈红色说明溶液中存在Fe3+,但Fe3+不一定是与K2FeO4将Cl-氧化,根据题干已知K2FeO4在酸性或中性溶液中快速产生O2,同时产生Fe3+,氯气是由酸性条件下次氯酸根与氯离子发生归中反应生成的。
方案II可以证明K2FeO4将Cl-氧化,方案II中采氢氧化钾溶液洗涤高铁酸钾,使K2FeO4稳定析出,并除去ClO,防止酸性条件下ClO与Cl发生反应产生Cl2,干扰实验。
(1)K2FeO4在酸性或中性溶液中快速产生O2,说明K2FeO4具有强氧化性,能够杀菌消毒,而FeO42被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质,所以可以用来净水;
(2)①A中用浓盐酸和高锰酸钾反应制备氯气,化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O;
②氯气中的主要杂质为浓盐酸挥发出的氯化氢气体,制备K2FeO4需在强碱条件下进行,应用饱和氯化钠溶液除去氯化氢气体。
③C中主要是Cl2、Fe(OH)3与KOH之间的反应制备K2FeO4,除了已知反应,还有Cl2与KOH的歧化反应:Cl2+2OH=Cl+ClO+H2O;
(3)①a.溶液中加入KSCN呈红色证明其中含有Fe3+,酸性条件下K2FeO4不稳定,因此生成Fe3+的反应还有:4FeO42+20H+=4Fe3++3O2↑+10H2O;
b.用氢氧化钾溶液洗涤的目的是洗去固体表面附着的氧化性离子ClO,以免对FeO42氧化Cl产生干扰,并在洗涤时保证K2FeO4的稳定性,避免FeO42在酸性或中性溶液中快速产生O2。
②实验中在碱性条件下Cl2制备FeO42,可以得出氧化性为Cl2>FeO42,而方案Ⅱ则得出相反的结论,主要是因为在酸性环境中氧化性FeO42>Cl2。


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】萜类化合物是天然物质中最多的一类物质,有些具有较强的香气和生理活性。某些萜类化合物可以相互转化。下列说法错误的是
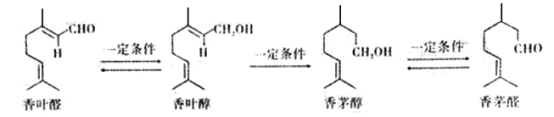
A. 香叶醛的分子式为C10H16O
B. 香叶醇和香茅醛互为同分异构体
C. 上述四种物质均能使酸性高锰酸钾溶液或溴水褪色
D. 香茅醇可以发生取代反应加成反应及氧化反应,但是不能发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二氧化硅是很坚硬的固体,而二氧化碳是气体,这一差别的根本原因是( )
A.二氧化硅不溶于水,二氧化碳能溶于水
B.硅元素与碳元素的非金属活泼性不同
C.二氧化硅分子与二氧化碳分子的结构不同
D.二氧化硅是具有立体网状结构的晶体,二氧化碳则是由分子组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。
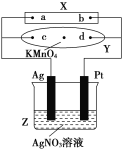
(1)Y中总反应的化学方程式为__________________,滤纸上c点附近会变________色。
(2)电解一段时间后,产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液的pH是________,需加入________g的________可使溶液复原。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组利用下图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
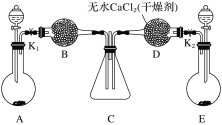
(1)A和E中制取NH3的装置为_____,所用试剂为___,装置中制取NO2的化学方程式是___________________。
(2)若NO2能够被NH3还原,预期观察到C装置中的现象是______________________。
(3)实验过程中,一段时间内未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③______________。
(4)此实验装置存在一个明显的缺陷是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合图像的是 ( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I—(aq)![]() I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法都正确的是
I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法都正确的是

①反应I2(aq) +I—(aq)![]() I3—(aq)的
I3—(aq)的![]() H>0
H>0
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,在该混合液中加水,c(I3—)/c(I2)将变大
A. 只有①② B. 只有②③ C. ②③④ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中物质分类组合完全正确的是( )
A | B | C | D | |
酸 | HCl | H2SO4 | NaHSO4 | HNO3 |
碱 | Na2CO3 | NaOH | Fe(OH)3 | KOH |
盐 | CuSO4 | BaSO4 | NaCl | NaHCO3 |
氧化物 | H2O | KClO3 | CuO | Na2O |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com