
 ;A为氧离子,氧离子的核电荷数为8,核外电子总数为10,氧离子结构示意图为:
;A为氧离子,氧离子的核电荷数为8,核外电子总数为10,氧离子结构示意图为: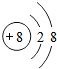 ,
, ;
;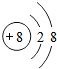 ;
;

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:

| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |

| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置用于分离CCl4和H2O的混合物 |
B、 装置用于收集H2、CO2、Cl2等气体 |
C、 装置用于吸收NH3或HCl,并防止倒吸 |
D、 装置用于收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基
是食品添加剂的增香原料,其香味比香草醛更浓郁.写出乙基
| CrO3/H2SO4 |
 )是一种医药中间体,请设计合理方案用茴香醛(
)是一种医药中间体,请设计合理方案用茴香醛( )合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
)合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示,(注:第一次平衡时c(I-)=2×10-3mol/L,c(Pb2+)=2×10-3mol/L)下列有关说法正确的是( )
常温下,取一定量的PbI2固体配成饱和溶液,T时刻改变某一条件,离子的浓度变化如图所示,(注:第一次平衡时c(I-)=2×10-3mol/L,c(Pb2+)=2×10-3mol/L)下列有关说法正确的是( )| A、常温下,Ksp=2×10-6 |
| B、温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的溶解度不变,c(Pb2+)不变 |
| C、T时刻改变的条件是升高温度,PbI2的,Ksp 增大 |
| D、常温下Ksp[PbS]=8×10-28,向PbI2的悬浊液中加入Na2S溶液,PbI2(s)+S2-(aq)?PbS(s)+2I-(aq)反应的化学平衡常数为5×1018 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碘水中滴加CCl4,振荡静置后分层,CCl4层呈紫红色,说明可用CCl4从碘水中萃取碘 |
| B、向SO2水溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,说明BaSO3难溶于盐酸 |
| C、向0.1mol?L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色,说明Fe2+具有氧化性 |
| D、向2.0mL浓度均为0.1mol?L-1的KCl、KI混合溶液中滴加1~2滴0.01mol?L-1 AgNO3溶液,振荡,沉淀呈黄色,说明同温度下AgCl的Ksp比AgI的Ksp 大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电影有一条光束,说明空气是一种胶体,故空气带电 |
| B、铁闸连接铜片,可防止被海水腐蚀 |
| C、硫酸亚铁铵晶体过滤后,用无水乙醇替代水洗涤,可减少晶体损失 |
D、聚合物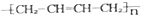 的单体为CH3-CH=CH-CH3 的单体为CH3-CH=CH-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在3支试管中分别放有:①1mL苯和3mL水;②1mL溴苯和3mL水;③1mL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL苯和3mL水;②1mL溴苯和3mL水;③1mL乙醇和3mL水.图中三支试管从左到右的排列顺序为( )| A、①②③ | B、①③② |
| C、②①③ | D、②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌粒与稀硫酸的反应 |
| B、灼热的木炭与CO2反应 |
| C、甲烷在氧气中的燃烧反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com