
分析 (1)Al与硫酸铜反应生成硫酸铝和Cu;
(2)Al与NaOH溶液反应,而Fe不能;
(3)氯气与氯化亚铁反应生成氯化铁;
(4)过氧化氢与亚铁离子反应可除杂,不引入新杂质;
(5)氯气与NaOH溶液反应可处理;
(6)硫离子被氧气氧化生成S.
解答 解:(1)Al与硫酸铜反应生成硫酸铝和Cu,离子反应为2Al+3Cu2+═2Al3++3Cu,故答案为:2Al+3Cu2+═2Al3++3Cu;
(2)Al与NaOH溶液反应,而Fe不能,离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(3)氯气与氯化亚铁反应生成氯化铁,离子反应为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(4)过氧化氢与亚铁离子反应可除杂,不引入新杂质,离子反应为2Fe2++2H++H2O2═2Fe3++2H2O,故答案为:2Fe2++2H++H2O2═2Fe3++2H2O;
(5)氯气与NaOH溶液反应可处理,离子反应为Cl2+2OH-═Cl-+ClO-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(6)硫离子被氧气氧化生成S,离子反应为2S2-+O2+2H2O═2S↓+4OH-,故答案为:2S2-+O2+2H2O═2S↓+4OH-.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2 | |
| B. | 一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA | |
| C. | 常温下18g铝放入足量浓硫酸中转移电子数2NA | |
| D. | 1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的FeCl3溶液中:HCO3-、K+、SO42-、Br- | |
| B. | 滴入酚酞试液显红色的溶液中:NH4+、SO42-、Fe2+、Cl- | |
| C. | 通入大量SO2的溶液中:Na+、Cl-、S2-、SO42- | |
| D. | pH=1的溶液中:Mg2+、Ca2+、NO3-、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
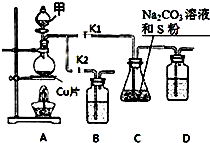 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图.已知:Na2S2O3在酸性溶液中不能稳定存在.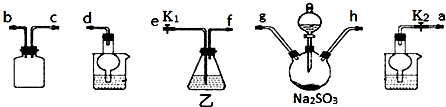
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | v(H2C2O4) | v(KMnO4) | KMnO4褪色时间 |
| 40℃ | 10mL | 10mL | 40s |
| 40℃ | 20mL | 20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,有三种元素化合价发生改变 | |
| B. | 该反应的氧化剂为BrF3,氧化产物为O2 | |
| C. | 1.5molBrF3参加反应,有4mole一转移 | |
| D. | 1.5molH2O参加反应,被H2O还原的BrF3为0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1KSCN溶液,静置. | 出现白色沉淀. |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液. | 溶液变红色. |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1AgNO3溶液. | 出现白色沉淀,溶液红色变浅. |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1KI溶液. | 出现黄色沉淀. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com