
| A. | 一种滤液显碱性,另一种滤液显中性 | |
| B. | 两种滤液均显碱性 | |
| C. | 一种滤液显碱性,另一种滤液显酸性 | |
| D. | 两种滤液均显酸性 |
分析 将H2SO4,Na2CO3,Ba(OH)2三种溶液,两两混合后,恰好完全反应,其中有沉淀生成的是Ba(OH)2分别与H2SO4和Na2CO3的反应.根据产物来分析.
解答 解:H2SO4,Na2CO3,Ba(OH)2三种溶液,两两混合后,恰好完全反应,其中有沉淀生成的是Ba(OH)2分别与H2SO4和Na2CO3的反应.
则H2SO4与Ba(OH)2反应生成BaSO4和水,过滤后的滤液呈中性;
Na2CO3与Ba(OH)2反应生成BaCO3和氢氧化钠,过滤后的滤液呈碱性;
故选A.
点评 本题考查了酸碱盐之间的反应,应注意审题,要求学生在平时的学习中加强基础知识的储备,熟记物质间反应的实验现象.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔比1:1 | B. | 摩尔比1:2 | C. | 质量比1:1 | D. | 质量比7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用98%的浓硫酸替代稀硫酸 | B. | 降低温度 | ||
| C. | 用铝粉代替铝片 | D. | 加入Na2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2c}{b-a}$ | B. | $\frac{b}{2(c-a)}$ | C. | $\frac{c-a}{b-a}$ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
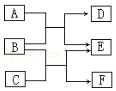 物质A~F都是初中化学中的常见物质,其中物质A是一种酸,物质C是一种盐,它们有如图所示的转化关系.反应①为A+B=D+E,反应②为B+C=E+F
物质A~F都是初中化学中的常见物质,其中物质A是一种酸,物质C是一种盐,它们有如图所示的转化关系.反应①为A+B=D+E,反应②为B+C=E+F查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能全部透过半透膜 | |
| B. | 能产生丁达尔效应 | |
| C. | 所得液体一定能导电 | |
| D. | 所得混合物不稳定,静置后容易产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
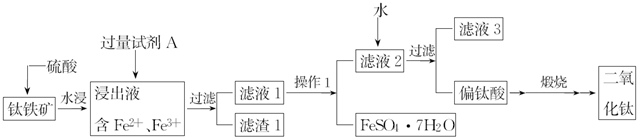
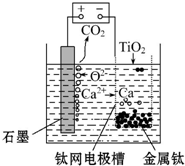
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com