
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式_________,E2+价电子的轨道表示式_________________。
(2)这5种元素中电负性最大的元素是_____(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为_______________(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式_____________。
【答案】3s23p1![]() ON>O>CN3->O2->Al3+
ON>O>CN3->O2->Al3+![]()
【解析】
试题A元素基态原子的价电子排布式为nsnnpn,则n=2,所以A是碳元素;D元素简单离子是第三周期元素中离子半径最小的,则D是Al元素;C元素最外层电子数是电子层数的3倍,原子序数小于Al,则C是氧元素,B元素基态原子中的未成对电子数是同周期中最多的,则B是N;E元素价电子层中的未成对电子数为4,则E的价层电子排布是3d64s2,即为铁元素,结合选项分析解答。
解析:(1)Al元素的原子序数是13,其基态原子的价电子排布式为3s23p1,Fe2+价电子的轨道表示式为![]() 。
。
(2)非金属性越强,电负性越大,则这5种元素中电负性最大的元素是O;非金属性越强,第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,则A、B、C三种元素的第一电离能由大到小的顺序为N>O>C。
(3)核外电子排布相同的离子,其离子半径随原子序数的增大而减小,则B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+。
(4)氧元素的核外有18个电子的氢化物是双氧水,属于共价化合物,电子式为![]() 。
。


科目:高中化学 来源: 题型:
【题目】丙三酸是一种有机酸,用H3A表示。25℃时,向1molL-1的H3A溶波中逐滴加入NaOH溶液,滴加过程中各种含A微粒物质的物质的量分数(δ)随溶液pH的变化曲线如图所示。下列相关说法错误的是( )
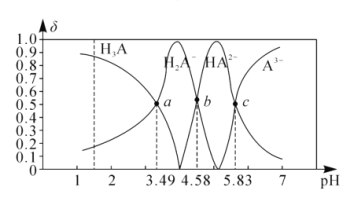
A.a点溶液中:c(H2A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,H3A的第二步电离平衡常数的数量级为10-5
C.b点溶液中:c(Na+)+c(H+)=3c(H2A-)+3c(A3-)+c(OH-)
D.当该溶液中c(HA2-)=c(A3-)时,溶液中水电离出的c(H+)>10-7molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸的熔点为122.13℃,微溶于水,易溶于酒精,实验室制备少量苯甲酸的流程如图:
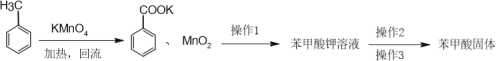
下列叙述不正确的是( )
A.冷凝回流的目的是提高甲苯的转化率
B.加入KMnO4反应后紫色变浅或消失,有浑浊生成
C.操作1为过滤,操作2为酸化,操作3为过滤
D.得到的苯甲酸固体用酒精洗涤比用水洗涤好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写不正确的是
A.HNO3=H+ + NO![]() B.Al2(SO4)3=2Al3+ + 3SO
B.Al2(SO4)3=2Al3+ + 3SO![]()
C.Ba(OH)2=Ba2+ + 2OH-D.NaHCO3=Na+ + H+ + CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔奖授予JohnB.Goodenough等三位科学家,以表彰其在锂电池领域的贡献。磷酸亚铁锂(LiFePO4)用作锂离子电池正极材料,制备方法如图:

(1)制备水合磷酸铁(FePO4·xH2O)固体
①过程Ⅰ,加NaOH溶液调pH=2.0时透明混合溶液中含磷微粒主要是H2PO4-,过程Ⅰ发生的主要离子方程式是____。
②过程Ⅱ“氧化、沉淀”反应生成FePO4沉淀的离子方程式是____。
③进行过程III之前,需确认过程II中无Fe2+,检验试剂为____。
④FePO4·xH2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图:

水合磷酸铁的化学式为____。(x取整数)
(2)制备LiFePO4固体:
在氮气气氛保护下,高温焙烧FePO4、Li2CO3和过量葡萄糖的固体混合物。
①过量葡萄糖作用是____。
②锂离子电池在充电时,电极材料LiFePO4会迁出部分Li+,部分转变为Li(1-x)FePO4。此电极的电极反应为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 10g 46%的乙醇水溶液中所含氢原子数目为0.6NA
B. 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA
C. 标准状况下,2.24LCH2Cl2含有分子的数目为0.1NA
D. 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-离子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P)的合成路线如图所示:

已知:①HC![]() CH+RCOOH
CH+RCOOH![]() RCOOCH=CH2
RCOOCH=CH2
②RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
(1)B中的官能团是__。
(2)C的结构简式是__。
(3)D→E的反应类型是__。
(4)E→G的化学方程式是__。
(5)已知:H是芳香族化合物。在一定条件下2B→K+H2O,K的核磁共振氢谱只有一组峰。J→L的化学方程式是__。
(6)L在体内可较快转化为具有药效的J,而P与L相比,在体内能缓慢持续释放J。
①血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用:__。
②下列说法正确的__(填字母)。
a.P中的酯基在体内可缓慢水解,逐渐释放出J
b.P在体内的水解产物中没有高分子化合物
c.将小分子药物引入到高分子中可以实现药物的缓释功能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com