
【题目】A~G各物质间的关系如下图,其中B、D为气态单质。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为__________________________;
若只能在加热情况下进行,则反应物A应为________;
(3)写出D转化为G的化学方程式_____________________________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂是________,实验现象为________________________________________。
【答案】浓盐酸 四氧化三铁 2H2O2![]() 2H2O+O2↑ KClO3 2Fe + 3Cl2
2H2O+O2↑ KClO3 2Fe + 3Cl2![]() 2FeCl3 铁粉 KSCN溶液 溶液变为血红色
2FeCl3 铁粉 KSCN溶液 溶液变为血红色
【解析】
本题的突破点是MnO2,在中学化学中MnO2参与的反应主要是氧气和氯气的制备,所以依据框图的转化特点可知B是氧气,D是氯气,C是浓盐酸,E是四氧化三铁,F是氯化亚铁,G是氯化铁;Fe2+具有还原性,因此配制时需要加入铁粉防止被氧化;利用有关元素化合物知识,从质量守恒的角度书写化学方程式。
(1) 在中学化学中MnO2参与的反应主要是氧气和氯气的制备,所以依据框图的转化特点可知B是氧气,D是氯气,C是浓盐酸,E是四氧化三铁,F是氯化亚铁,G是氯化铁;
(2) MnO2参与制备氧气的反应有两种,一种是MnO2做催化剂的条件下,常温下H2O2分解制得氧气,其反应方程式为2H2O2![]() 2H2O+O2↑;另一种是由MnO2做催化剂的条件下,加热KClO3分解制得氧气,所以A为KClO3;
2H2O+O2↑;另一种是由MnO2做催化剂的条件下,加热KClO3分解制得氧气,所以A为KClO3;
(3)D为Cl2,G为FeCl3,Fe在氯气中燃烧生成FeCl3的化学方程式为2Fe + 3Cl2![]() 2FeCl3;
2FeCl3;
(4) Fe2+具有还原性,易被空气中的氧气所氧化,因此新配制的氯化亚铁溶液需要加入铁粉防止被氧化成Fe3+;检验FeCl3溶液中阳离子的常用试剂是KSCN溶液,实验现象为滴加KSCN溶液后,溶液变为血红色。


科目:高中化学 来源: 题型:
【题目】据报道,某种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用较长时间。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。
2K2CO3+6H2O。
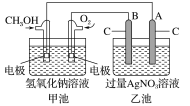
请填空:
(1)充电时,①燃料电池的负极与电源________极相连。
②阳极的电极反应式为:________________________。
(2)放电时:负极的电极反应式为:__________________。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2____________L(标准状况)。
(4)若在常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应.请回答下列问题:
(1)写出B、C、E元素的名称B___________、C__________、E_____________。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为____________。
(3)不能验证C和F两种元素非金属性强弱的结论是(填编号)________。
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为________、________,这两种酸式盐相互反应的离子方程式为_______。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为___________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________。
①a mol ②b mol ③ a/3mol ④ b/3mol ⑤0 ⑥(4a﹣b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行下列实验,试管内试剂可按需要更换,实验不产生污染性气体且能成功的是 ( )

A.加热NaHCO3制CO2,并用澄清石灰水检验CO2
B.用Cu与浓硫酸反应制少量SO2,并检验SO2的漂白性
C.加热NH4Cl制NH3,并检验氨气溶于水后显碱性
D.用醋酸与乙醇、浓硫酸混合反应制乙酸乙酯,并观察生成的乙酸乙酯的状态、气味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=12的X、Y两种碱溶液各10mL,分别稀释至1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
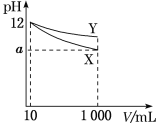
A. 若10<a<12,则X、Y都是弱碱
B. X、Y两种碱的物质的量浓度一定相等
C. 完全中和pH相同的X、Y两溶液时,消耗同浓度盐酸的体积:V(X)>V(Y)
D. 稀释后,X溶液的碱性比Y溶液的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,2.24 L CHCl3 所含共价键数为0.4NA
B.常温常压下,2 g羟基(18OD)所含的中子数为NA
C.常温常压下,1.5 g NO与1.6 g O2充分反应后混合物中原子总数为0.2NA
D.常温下,2 L 0.1 molL-1FeCl3 溶液与1 L 0.2 molL-1FeCl3 溶液所含Fe3+数目相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制0.5mol/L的NaOH溶液时,如果只存在下列问题,溶液的浓度如何变化?(填“偏高”、“偏低”、或“不变”)。
(1)称量NaOH固体时,天平的砝码粘有油污,其结果________________。
(2)向容量瓶中加蒸馏水超过了刻度线后,又用滴管把多出的部分吸走,其结果____。
(3)观察刻度线时仰视,其结果________________。
(4)所用容量瓶中已有少量蒸馏水,其结果___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 在一定条件,化合物Y可与HCHO发生缩聚反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com