
在高温、高压和催化剂条件下的密闭容器中,进行反应:N2(g)+3H2(g) 2NH3(g) (正反应放热)。下列有关说法不正确的是( )
2NH3(g) (正反应放热)。下列有关说法不正确的是( )
A.使用催化剂是为了增大化学反应速率
B.增大氢气的浓度可增大反应速率
C.在上述条件下,氢气能全部转化为氨气
D.达到平衡时,体系中各物质的浓度不再改变
科目:高中化学 来源: 题型:
某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氯气和氨气的发生装置,D为纯净、干燥的氯气与氨气反应的装置。通过查阅资料发现: 8NH3+3Cl2==6NH4Cl+N2
请回答下列问题:
(1)实验室用二氧化锰和浓盐酸反应制取氯气,写出该反应的化学方程式
(2)洗气瓶B的作用是 。C、E都是干燥装置,其中E中干燥管内所装的试剂是
(3)反应开始后装置D中出现浓厚的白烟并在容器内壁凝结,活动小组拟继续通过实验鉴定该固体的成分。请你协助他们完成该实验探究。
步骤①:取固体样品加少量水溶解,分装于两支试管中。向其中一支试管中加入浓NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口附近,红色石蕊试纸变蓝,证明该固体中一定含有的阳离子是
步骤②:
(4)从绿色化学的角度考虑该装置中有一明显不合理之处,请你提出改进的意见。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及其解释或结论都正确的是 ( )
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B.向1 mL 1%的NaOH 溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现砖红色沉淀,说明X中不含有醛基
C.向CuSO4溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀可能为CuI
D.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
医学研究证明,用放射性 I治疗肿瘤可收到疗效,下列有关
I治疗肿瘤可收到疗效,下列有关 I的叙述正确的是( )
I的叙述正确的是( )
A. I是碘的一种同素异形体
I是碘的一种同素异形体
B.  I -与Ag+不发生反应,可共存于同一溶液中
I -与Ag+不发生反应,可共存于同一溶液中
C. I核内的中子数与核外电子数之差为29
I核内的中子数与核外电子数之差为29
D. I位于元素周期表中第4周期ⅦA族
I位于元素周期表中第4周期ⅦA族
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两种金属元素:①与稀盐酸反应,甲比乙反应剧烈;②甲原子能与乙的阳离子发生置换反应;③甲的最高价氧化物对应的水化物碱性比乙的最高价氧化物对应的水化物碱性强;④甲与乙用导线连接浸入稀硫酸形成原电池,电流由乙到甲;⑤甲单质的熔沸点比乙的低。能说明甲的金属性比乙强的是 ( )
A.只有②③ B.只有②③⑤ C.只有①②③④ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量大,而且没有铅污染。其电池反应为2Zn+O2==2ZnO,原料为锌粒、电解液和空气,则下列叙述正确的是 ( )
A.锌为正极,空气进入负极反应 B.负极反应为Zn-2e-==Zn2+
C.正极发生氧化反应 D.电解质溶液可以是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
通过复习总结,你认为下列对化学知识概括合理的是
A.能跟酸反应的氧化物,都是碱性氧化物
B.凡具有正四面体结构的分子中,其键角均为109°28′
C.有新单质生成的化学反应一定都是氧化-还原反应
D.核外电子总数相同的原子,一定是同种元素的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的A、B、C、D、E、F、G七种前四周期元素(稀有气体除外),常温下,有三种元素对应的单质呈气态,C与D同族。其中A原子核外有六种不同运动状态的电子,C为地壳中含量做多的元素,F的简单离子是同周期主族元素形成的简单离子中氧化性最弱的,G的基态原子的最外能层只有一个电子,其他能层均已充满电子。
(1)电负性越大的原子,对键合电子的吸引能力越强,通常对应元素化合价呈现负价。根据B、C、D、E四种元素形成的常见化合物的化合价,确定电负性最大的元素,写出其基态原子的电子排布图 。
(2)甲是由B元素等非金属元素组成的离子化合物,甲可由E的氢化物溶液与电解质乙溶液反应生成,写出该反应的离子方程式 。
(3)A元素可形成多种单质,一种晶体结构如图一所示,该晶体与熔融的F单质相互作用,形成某种青铜色的物质(其中的元素F用“●”表示),原子分布如图二所示,该物质的化学式为 。另一种的晶胞如图三所示,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为___________g·cm-3(保留两位有效数字)。
 图一 图二 图三 图四
图一 图二 图三 图四
(4)G元素形成的单质,其晶体的堆积模型为________,G的醋酸盐晶体局部结构如图四,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
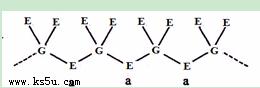
(5)E和F与不同价态的G可组成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均是由G和E两元素形成的无限长链结构(如下图),已知其中一种化合物的化学式为FGE3,另一种的化学式为 。
(6)若物质F2D3是一种含有非极性共价键的离子化合物,各原子最外层都满足8e-稳定结构,请你写出该化合物阴离子的电子式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的符号:
X 、Y 、Z 、W
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为 , 。
(3)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com