
【题目】下列说法正确的是
A. 相同温度下,pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
B. CH3COOH 溶液加水稀释后,溶液中 ![]() 的值减小
的值减小
C. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
D. 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
【答案】B
【解析】
本题主要考查离子浓度大小的比较。
A.pH相等的这几种物质中,NaOH的浓度最小,弱酸对应的酸根离子水解程度越大,其钠盐溶液浓度越小;
B.可通过微粒的物质的量变化分析;
C.根据温度不变,水的离子积常数为定值分析;
D.100℃时,KW![]() 10-14;
10-14;
A.pH相等的这几种物质,NaOH的浓度最小,酸根离子水解程度越大,其钠盐溶液浓度越小,pH相等的CH3COONa、NaOH和NaCO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa),错误;
B.CH3COOH溶液加水稀释后,醋酸电离程度增加,溶液稀释后,n(CH3COOH)减小,n(CH3COO-)增大,故![]() 的值减小,正确;
的值减小,正确;
C.pH=4的盐酸不断稀释过程中,c(H+)不断减小并逐渐接近![]() mol/L,稀释过程中温度几乎不变化,KW不变,根据KW=c(H+)·c(OH-)不变可知,c(OH-)逐渐增大并逐渐接近
mol/L,稀释过程中温度几乎不变化,KW不变,根据KW=c(H+)·c(OH-)不变可知,c(OH-)逐渐增大并逐渐接近![]() mol/L,错误;
mol/L,错误;
D.100℃时,pH=12的纯碱溶液中,c(H+)=10-12mol/L,但KW![]() 10-14,故c(OH-)
10-14,故c(OH-)![]() 1.0×10-2 mol·L-1,错误。
1.0×10-2 mol·L-1,错误。


科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今欲用Na2CO3固体配制500mL0.02mol/L的Na2CO3溶液。根据题意填空:
(1)配制该溶液应选用___mL容量瓶。
(2)用托盘天平称取___g固体Na2CO3。
(3)将称好的Na2CO3固体放至500mL的大烧杯中,倒入约200mL蒸馏水,用___搅拌至完全溶解。待冷却至室温后,将烧杯中的溶液用玻璃棒引流转移至容量瓶。
(4)用少量蒸馏水洗涤烧杯___次,并将每次洗涤的溶液都注入容量瓶,轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用____滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。
(6)配制好的溶液____(填“能”或“不能”)长期存放在容量瓶中。
(7)会使所配制的溶液浓度偏高的是____。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液
B.将烧杯中的溶液注入容量瓶后,未洗涤烧杯
C.加水定容时俯视容量瓶刻度线
D.在转移溶液时,容量瓶中已有少量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是

A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然水大多含Ca2+、Mg2+、HCO3-等离子,加热会产生水垢,水垢中一定含有CaCO3和Mg(OH)2,可能含有MgCO3。
(1)天然水中的HCO3-来自于空气中的CO2。用相关方程式表示CO2溶于水形成HCO3-的过程。______________________________________________________________
(2)天然水煮沸时,其中微溶的MgCO3转换成难溶的Mg(OH)2,写出发生反应的化学方程式。____________________________________________
为确定某水垢样品的成分,利用CaCO3、MgCO3、Mg(OH)2高温分解的性质,精确称量5.000g水垢样品,用如下图装置进行实验。
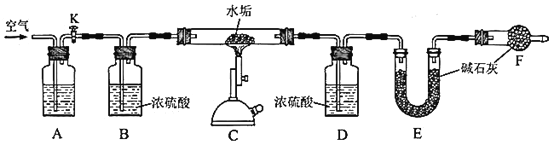
(3)A中盛放的试剂是__________。装置F的作用是_________________________。反应结束后,需要再通入一段时间的空气,目的是_______________________。
(4)利用上述装置测定水垢中Mg(OH)2的含量时,需要测量的数据有__________。
(5)实验测得装置E增重2.200g,请问水垢样品中是否含有MgCO3?判断依据是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图所示。下列说法不正确的是
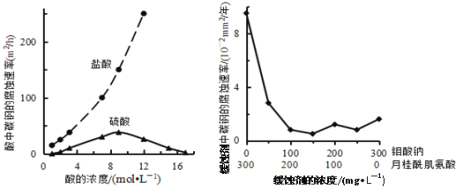
A. 盐酸的浓度越大,腐蚀速率越快
B. 钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小
C. 碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比
D. 对比盐酸和硫酸两条曲线,可知Cl—也会影响碳素钢的腐蚀速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)
(一)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
CH2=CH2(g)+CH3COOH(1)![]() CH3COOC2H5(1)
CH3COOC2H5(1)
(1)下列描述能说明固定容器中乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是___________。
A.乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.体系中气体密度一定
D.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
(2)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
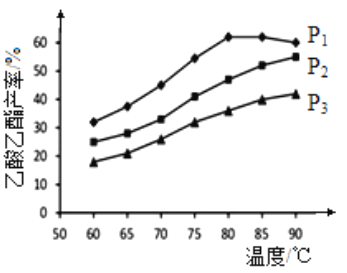
①温度在60~90℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是___________[用v(P1)、v(P2)、v(P3)分别表示不同压强下的反应速率],分析其原因为______________________。
②在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是______________________。
③根据测定实验结果分析,较适宜的生产条件是______________________(填出合适的压强和温度)。为提高乙酸乙酯的产量和纯度,可以采取的措施有______________________(任写出一条)。
(3)已知反应③的标准平衡常数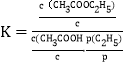 ,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在80℃和10MPa下反应,乙酸乙酯的平衡产率为80%,则KΘ=__________。
,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在80℃和10MPa下反应,乙酸乙酯的平衡产率为80%,则KΘ=__________。
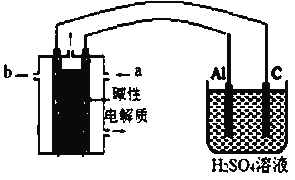
(二)某化学兴趣小组在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。可供选择的试剂有:甲醇,空气,KOH溶液,其中物质b是__________,铝电极的电极反应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:

(1)正反应是___热反应。
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____ 热反应,m+n___p+q(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com