
����Ŀ����4 mol X�����6 mol Y��������2 L�ܱ������У�ʹ���Ƿ������·�Ӧ��X(g)+2Y(g)=3Z(g)+nW(g)��5 minĩ������3 mol Z������֪��W��Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ0.2 mol��L��1��min��1������ѡ����ȷ����(����)
A.ǰ5 min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ0.5 mol��L��1��mol��1
B.5 minĩʱY��Ũ��Ϊ2 mol��L��1
C.��ѧ����ʽ��n=3
D.5 minĩʱW�����ʵ���Ϊ1 mol
���𰸡�B
��������
A.��ѧ��Ӧ�����뻯ѧ�����������ȣ��ݴ˼����ǰ5min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ���ʣ�
B.�������ɵ�Z�����ʵ�����������ĵ�Y�����ʵ������ټ����Y��Ũ�ȣ�
C.v(X)=0.1mol/(Lmin)����W��Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ0.2mol/(Lmin)����ѧ�������뷴Ӧ���ʳ����ȣ��ݴ˼���n��
D.��W��Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ0.2mol/(Lmin)���ݴ˼����5minĩʱW�����ʵ�����
A.5minĩ����3molZ��������X�����ʵ���Ϊ��n(X)=3mol��![]() =1mol����ǰ5min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��v(X)=
=1mol����ǰ5min����X��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��v(X)=![]() =0.1mol/(Lmin)��A����
=0.1mol/(Lmin)��A����
B.5minĩ������3molZ����Ӧ���ĵ�Y�����ʵ�����n(Y)=3mol��![]() =2mol����5minĩY��Ũ��Ϊ��c(Y)=
=2mol����5minĩY��Ũ��Ϊ��c(Y)=![]() =2mol/L��B��ȷ��
=2mol/L��B��ȷ��
C.v(X)��v(W)=0.1mol/(Lmin)��0.2mol/(Lmin)=1��n�����n=2��C����
D.5minĩʱW�����ʵ���Ϊ��n(W)=vtV=0.2mol/(Lmin)��5min��2L=2mol��D����
�ʺ���ѡ����B��


 �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʯ��ʯī��Ϊ̼��ͬ�������壬��������������ʱȼ������һ����̼������������ʱ���ȼ�����ɶ�����̼����Ӧ�������仯��ͼ��ʾ������˵����ȷ����

A.��ͨ��״���£����ʯ��ʯī���ȶ�
B.ʯī��ȼ����Ϊ![]()
C.
![]()
D.12gʯī��һ�����Ŀ�����ȼ�գ������������36g���ù��̷ų�������Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���Է����廯����AΪ��Ҫԭ�ϣ���������·�ϳɿ����ҩ��W��

��֪��![]()
��ش�
��1������˵����ȷ����________��
A.��Ӧ����������Ӧ B.�Լ�X��Ũ�����Ũ����
C.��Ӧ�ۢݵ�Ŀ���DZ���![]() D.ҩ��W�ķ���ʽ��
D.ҩ��W�ķ���ʽ��![]()
��2��д��������C�Ľṹ��ʽ________��
��3��д����Ӧ�Ļ�ѧ����ʽ________��
��4����ƴ�G��H�ĺϳ�·�ߣ�������ͼ��ʾ�����Լ���ѡ��________��
��5��д��������A������ͬϵ��Y��ͬ���칹��ṹ��ʽ���ұ����������������________��
���ܷ���������Ӧ��
��![]() �����������й���4��Hԭ�ӣ�
�����������й���4��Hԭ�ӣ�
�۳��˱�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ƽ���·���ʽ
K2Cr2O7+__HC1=__KC1+__CrCl3+__H2O+__Cl2��
���Ϸ�Ӧ��ʧ���ӵ�������_________����ԭ������______��ÿ����lmol���ֻ�ԭ�������_________mol���ӷ���ת�ƣ��������뻹ԭ�������ʵ���֮��Ϊ_________��
��2�������ڵ���Ԫ����Fe2+��Fe3+����ʽ���ڡ�Fe2+�ױ����գ����Բ���ʱ��Ӧ���京Fe2+�������Ρ�����ά����C��ʹʳ���е�Fe3+ת����Fe2+������������������ա�
�������о�������Fe2+��Fe3+��ת�����ɱ�ʾΪFe2+![]() Fe3+���ڹ���A�У�Fe2+��__________��������B�У�Fe3+��____________����
Fe3+���ڹ���A�У�Fe2+��__________��������B�У�Fe3+��____________����
��������ά����C��ʹʳ���е�Fe3+ת��ΪFe2+����仰ָ����ά����C�������Ӧ����_______��������_____________�ԡ�
��3����֪��Ӧ��2H2S+H2SO3=2H2O+3S��������������Ȼ�ԭ�����1.6g�����ʱ������ˮ������Ϊ____g��
��4����ȥNa2CO3��ĩ�л����NaHCO3������______��������ѧ����ʽΪ_______��
��5����FeBr2��Һ��ͨ������Cl2����֪������Cl2��Br2��Fe3+����ѧ����ʽΪ_______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ʒӵ�һ�ֺϳ�·����ͼ��

����˵������ȷ���ǣ� ��
A.������X������ˮ
B.��NaOHˮ��Һ�м��ȣ�������X�ɷ���ȡ����Ӧ
C.��һ��������������Y����CH3COOH�������۷�Ӧ
D.��FeCl3��Һ�ɼ�����X��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ܱ������г�������ʵ���������A��B��һ���¶��·�����ӦA(g)+xB(g) ![]() 2C(g)���ﵽƽ���ֻ�ı䷴Ӧ��һ��������������������ʵ�Ũ�ȡ���Ӧ������ʱ��ı仯����ͼ��ʾ������˵������ȷ��
2C(g)���ﵽƽ���ֻ�ı䷴Ӧ��һ��������������������ʵ�Ũ�ȡ���Ӧ������ʱ��ı仯����ͼ��ʾ������˵������ȷ��
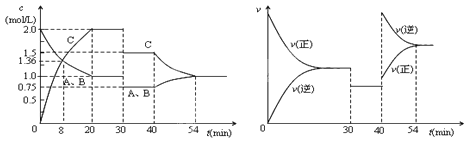
A.ǰ8min A��ƽ����Ӧ����Ϊ0.08mol/(L��s)
B.30minʱ���������������40minʱ�����¶�
C.��Ӧ����ʽ�е�x��1������ӦΪ���ȷ�Ӧ
D.30min��54min�ķ�Ӧ��ƽ�ⳣ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ�ƽԭ��������ˮ����������̺����ϸߣ�����д������ܴﵽ����ˮ��������ˮ�����̵���Դ��Ҫ�ǿ���FeCO3��MnCO3��
(1)�����������ˮ�����������ߣ���ϻ�ѧ�����ƽ���ƶ��ǶȽ���ԭ��_______��
(2)ȥ��Fe2+
�ٳ����˳ؾ�������3��7������ϱ����γ�______ɫ���ʣ���ɷ���Fe(OH)3��ʹ����Һ��Fe2+����Ѹ���½��������ù�����ͼ��ʾ��
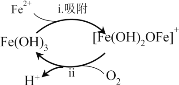
�ڽ�����ii�����ӷ���ʽ����������________��
����i��Fe2++Fe(OH)3=[Fe(OH)2OFe]++H+
����ii��4[Fe(OH)2OFe]++ +10H2O= +
����������߹���ii��Ӧ���ʵĴ�ʩ��______(�����)��
A. �����¶� B. ͨ������O2 C. ����
(3)ȥ��Mn2+
������˳��м���ClO2��Mn2+����ΪMnO2�����ŷ�Ӧ���У��˳���Һ��pH___(�������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������Ȼ�ѧ����ʽ���ش�����������
2H2(g)+O2(g)![]() 2H2O��1�� ��H=571.6 kJ �� mol1
2H2O��1�� ��H=571.6 kJ �� mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ��H=2 220 kJ �� mol1
3CO2(g)+4H2O(l) ��H=2 220 kJ �� mol1
��1��H2��ȼ����Ϊ_______��C3H8��ȼ����Ϊ_______��
��2��1 mol H2��2 mol C3H8��ɵĻ��������ȫȼ���ͷŵ�����Ϊ______________��
��3������H2��C3H8�Ļ�����干5 mol����ȫȼ��ʱ����3 847 kJ�����ڻ��������H2��C3H8���������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ָ�ڸ����ı����γ�һ�������������ļ������̡����е�һ����ӦΪ��3Fe+ NaNO2+ 5 NaOH= 3Na2FeO2+ H2O+ NH3�������ڸ÷�Ӧ˵����ȷ����![]()
A.��Ӧ��NԪ�ر�����
B.NaFeO2������������Ҳ�ǻ�ԭ����
C.������Ӧ������ÿ��![]() �μӷ�Ӧ��ת��
�μӷ�Ӧ��ת��![]() ����
����
D.�������뻹ԭ�������ʵ���֮��Ϊ3:1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com