
【题目】我国平原地区地下水质量差,铁、锰含量较高,需进行处理才能达到饮用水标准。地下水中铁锰的来源主要是矿物FeCO3和MnCO3。
(1)酸雨地区地下水中铁含量更高,结合化学用语从平衡移动角度解释原因_______。
(2)去除Fe2+
①除铁滤池经过曝气3~7天后,滤料表面形成______色物质,其成分是Fe(OH)3,使得溶液中Fe2+含量迅速下降,其作用过程如图所示。
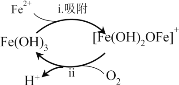
②将过程ii的离子方程式补充完整:________。
过程i:Fe2++Fe(OH)3=[Fe(OH)2OFe]++H+
过程ii:4[Fe(OH)2OFe]++ +10H2O= +
③有利于提高过程ii反应速率的措施是______(填序号)。
A. 降低温度 B. 通入足量O2 C. 搅拌
(3)去除Mn2+
向除锰滤池中加入ClO2将Mn2+氧化为MnO2,随着反应进行,滤池溶液的pH___(填“变大”“变小”或“不变”)。
【答案】FeCO3(s)![]() Fe2+(aq)+CO32-(aq),酸雨中含H+,结合CO32-,使得平衡正向移动,增大地下水中Fe2+的浓度 红褐 4[Fe(OH)2OFe]++O2+10H2O=8Fe(OH)3+4H+ BC 变小
Fe2+(aq)+CO32-(aq),酸雨中含H+,结合CO32-,使得平衡正向移动,增大地下水中Fe2+的浓度 红褐 4[Fe(OH)2OFe]++O2+10H2O=8Fe(OH)3+4H+ BC 变小
【解析】
(1)根据FeCO3在溶液中存在沉淀溶解平衡分析;
(2)①根据Fe(OH)3是红褐色难溶性物质分析;
②根据题目已知条件,结合电子守恒、电荷守恒、原子守恒,书写方程式;
③根据化学反应速率的影响因素分析;
(3)结合发生的氧化还原反应,分析溶液中H+离子浓度变化进行判断。
(1)FeCO3难溶于水,在溶液中存在沉淀溶解平衡:FeCO3(s)![]() Fe2+(aq)+CO32-(aq),酸雨中含有H+浓度较大,H+结合CO32-形成HCO3-,使得溶液中c(CO32-)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大;
Fe2+(aq)+CO32-(aq),酸雨中含有H+浓度较大,H+结合CO32-形成HCO3-,使得溶液中c(CO32-)浓度降低,沉淀溶解平衡正向移动,最终使地下水中Fe2+的浓度增大;
(2)①除铁滤池经过曝气3~7天后,表面被氧化产生Fe(OH)3,由于Fe(OH)3是红褐色难溶性物质,因此会看到滤料表面形成红褐色物质;
②根据电子守恒、原子守恒电荷守恒,可得过程ii的离子方程式为:4[Fe(OH)2OFe]++O2+10H2O=8Fe(OH)3+4H+;
③A. 降低温度,物质具有的能量降低,反应速率减低,A不符合题意;
B. 通入足量O2,增大了反应物浓度,化学反应速率加快,B符合题意;
C. 搅拌能够使反应物充分接触,反应物接触面积增大,反应速率加快,C符合题意;
故合理选项是BC;
(3)向除锰滤池中加入ClO2可将Mn2+氧化为MnO2,在溶液中发生反应:2ClO2+6H2O+5Mn2+=2Cl-+5MnO2+12H+,可见随着反应进行,滤池溶液中c(H+)增大,导致溶液的酸性增强,溶液的pH变小。


科目:高中化学 来源: 题型:
【题目】恒温恒容条件下发生反应:2NO2(g)![]() N2O4(g),下列叙述能够标志该反应达到化学平衡状态的有
N2O4(g),下列叙述能够标志该反应达到化学平衡状态的有
①体系的压强不再改变 ②气体的颜色不再改变
③气体的平均摩尔质量不再改变 ④混合气体的密度不再改变
⑤各组分的体积分数不再改变 ⑥原子总数不再改变
⑦混合气体分子总数不再改变 ⑧c(NO2):c(N2O4)=2:1,且比值不再改变
⑨v(NO2)正=2v(N2O4)逆
A.①②③⑤⑦⑧⑨B.②③⑤⑦⑨C.④⑤⑥⑦D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】潜艇中氧气来源之一的反应是:2Na2O2+2H2O=4NaOH+O2↑。用NA表示阿伏加德罗常数,下列说法正确的是( )
A.22.4LO2含2NA个O原子
B.1.8gH2O含有的质子数为NA
C.1molNa2O2含共价键的总数为2NA
D.上述反应,每生成1molO2转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把4 mol X气体和6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:X(g)+2Y(g)=3Z(g)+nW(g),5 min末已生成3 mol Z,若测知以W的浓度变化来表示的反应速率为0.2 mol·L-1·min-1,下列选项正确的是( )
A.前5 min内用X的浓度变化表示的平均反应速率为0.5 mol·L-1·mol-1
B.5 min末时Y的浓度为2 mol·L-1
C.化学方程式中n=3
D.5 min末时W的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,1 NA 个CO2分子占有的体积为22.4L
B.常温常压下,14gN2含有原子数为0.5NA
C.常温常压下,14gCO的质子数为7NA
D.74.5 g KCl固体中含有KCl分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
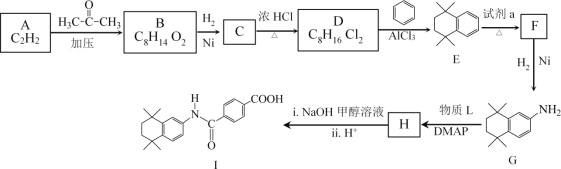
【题目】他米巴罗汀(I)可用于治疗急性白血病,其合成研究具有重要意义,合成路线如图所示。
已知:i.HC![]() CH+
CH+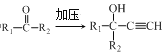
ii.R—NO2![]() R—NH2
R—NH2
iii.R1—NH2+![]() +HCl
+HCl
(1)A中官能团名称是_________。
(2)B的结构简式是________。
(3)D→E的化学方程式是__________。
(4)试剂a是_________。
(5)已知H在合成I的同时,还生成甲醇,G→H所加物质L的结构简式是______。
(6)B的一种同分异构体符合下列条件,其结构简式是________。
①能发生银镜反应
②核磁共振氢谱只有两组吸收峰
(7)D→E的过程中有多种副产物,其中属于高分子化合物的结构简式是_______。
(8)![]() 也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。
也是合成他米巴罗汀(I)的一种原料,合成路线如图所示。利用题中所给信息,中间产物的结构简式是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 600 | 800 | 830 | 1000 | 1200 |
K | 0.25 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K = 。
(2)该反应为 反应(选填“吸热”、“放热”)。反应达平衡后,若再通入一定量CO2,则平衡常数K将________,CO2的转化率________。(填“增大”、“减小”或“不变”)
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变 c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)若 600℃时,向容器中充入1mol CO、1mol H2O,反应达到平衡后,CO的转化率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柴油机车尾气脱![]() 是在全球范围内受关注的热点问题。
是在全球范围内受关注的热点问题。
(1)柴油机车尾气中的![]() 是空气中的
是空气中的![]() 在高温中燃烧生成的,其生成的反应机理如下:
在高温中燃烧生成的,其生成的反应机理如下:
A22A·
A+B2NO+B·
B·+A2NO+A·
已知![]() 时的键能数据:
时的键能数据:
化学键 | O=O | N≡N | N=O |
键能/kJ·mol-1 | 498.0 | 946.0 | 630.0 |
①上述机理中![]() 代表的是________(填“
代表的是________(填“![]() ”或“
”或“![]() ”),作出该判断的原因是________。
”),作出该判断的原因是________。
②根据上述![]() 的生成机理,试写出通常状况下
的生成机理,试写出通常状况下![]() 燃烧生成
燃烧生成![]() 的热化学方程式:________。
的热化学方程式:________。
(2)TWC技术是利用燃料不完全燃烧生成的![]() 将尾气中的
将尾气中的![]() 还原为无害气体的技术,且 2NO+2CO
还原为无害气体的技术,且 2NO+2CO![]() 2CO2+N2 △H<0。现将含COa%(体积分数,下同)、NO0.30%的模拟汽车尾气以100mL·min-1的流速通过450℃的反应器,出口气体中CO的含量变为b%(气体体积变化忽略不计),则v(CO)=________mL·min-1。若将反应器温度降低至350℃,出口气体中CO的含量________b%(填“>”“<”或“=”)
2CO2+N2 △H<0。现将含COa%(体积分数,下同)、NO0.30%的模拟汽车尾气以100mL·min-1的流速通过450℃的反应器,出口气体中CO的含量变为b%(气体体积变化忽略不计),则v(CO)=________mL·min-1。若将反应器温度降低至350℃,出口气体中CO的含量________b%(填“>”“<”或“=”)
(3)SCR技术是利用![]() 将尾气中的
将尾气中的![]() 选择性还原为无害气体的技术。其中
选择性还原为无害气体的技术。其中![]() 是通过尿素[CO(NH2)2]分解生成的:
是通过尿素[CO(NH2)2]分解生成的:
Ⅰ.CO(NH2)2(s)NH3(g)+HNCO(g) H1
Ⅱ.HNCO(g)+H2O(g)NH3(g)+CO2(g) H2
①一定温度下,往一恒容密闭容器中投入足量的CO(NH2)2固体和一定量的水蒸气,发生上述反应。当反应达到平衡时,测得c(NH3)=pmol/L、c(HNCO)=qmol/L,则反应Ⅰ的平衡常数为________(用含p、q的表达式表示,下同),c(CO2)=________mol/L。
②我国科学家在研究温度、氧气浓度对尿素水解产物浓度的影响后,得到如下数据:
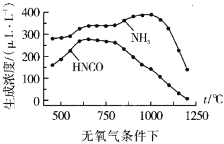
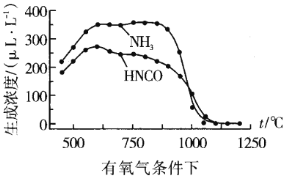
通过数据对比可以发现在有氧气、1100℃以上时,体系中![]() 浓度接近0μLL-1,其可能原因:__
浓度接近0μLL-1,其可能原因:__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
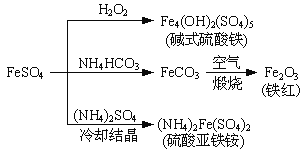
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com