
ЁОЬтФПЁПВёгЭЛњГЕЮВЦјЭб![]() ЪЧдкШЋЧђЗЖЮЇФкЪмЙизЂЕФШШЕуЮЪЬтЁЃ
ЪЧдкШЋЧђЗЖЮЇФкЪмЙизЂЕФШШЕуЮЪЬтЁЃ
(1)ВёгЭЛњГЕЮВЦјжаЕФ![]() ЪЧПеЦјжаЕФ
ЪЧПеЦјжаЕФ![]() дкИпЮТжаШМЩеЩњГЩЕФЃЌЦфЩњГЩЕФЗДгІЛњРэШчЯТЃК
дкИпЮТжаШМЩеЩњГЩЕФЃЌЦфЩњГЩЕФЗДгІЛњРэШчЯТЃК
A22AЁЄ
A+B2NO+BЁЄ
BЁЄ+A2NO+AЁЄ
вбжЊ![]() ЪБЕФМќФмЪ§ОнЃК
ЪБЕФМќФмЪ§ОнЃК
ЛЏбЇМќ | O=O | NЁдN | N=O |
МќФм/kJЁЄmol-1 | 498.0 | 946.0 | 630.0 |
ЂйЩЯЪіЛњРэжа![]() ДњБэЕФЪЧ________(ЬюЁА
ДњБэЕФЪЧ________(ЬюЁА![]() ЁБЛђЁА
ЁБЛђЁА![]() ЁБ)ЃЌзїГіИУХаЖЯЕФдвђЪЧ________ЁЃ
ЁБ)ЃЌзїГіИУХаЖЯЕФдвђЪЧ________ЁЃ
ЂкИљОнЩЯЪі![]() ЕФЩњГЩЛњРэЃЌЪдаДГіЭЈГЃзДПіЯТ
ЕФЩњГЩЛњРэЃЌЪдаДГіЭЈГЃзДПіЯТ![]() ШМЩеЩњГЩ
ШМЩеЩњГЩ![]() ЕФШШЛЏбЇЗНГЬЪНЃК________ЁЃ
ЕФШШЛЏбЇЗНГЬЪНЃК________ЁЃ
(2)TWCММЪѕЪЧРћгУШМСЯВЛЭъШЋШМЩеЩњГЩЕФ![]() НЋЮВЦјжаЕФ
НЋЮВЦјжаЕФ![]() ЛЙдЮЊЮоКІЦјЬхЕФММЪѕЃЌЧв 2NO+2CO
ЛЙдЮЊЮоКІЦјЬхЕФММЪѕЃЌЧв 2NO+2CO![]() 2CO2+N2 ЁїHЃМ0ЁЃЯжНЋКЌCOa%(ЬхЛ§ЗжЪ§ЃЌЯТЭЌ)ЁЂNO0.30%ЕФФЃФтЦћГЕЮВЦјвд100mLЁЄmin-1ЕФСїЫйЭЈЙ§450ЁцЕФЗДгІЦїЃЌГіПкЦјЬхжаCOЕФКЌСПБфЮЊb%(ЦјЬхЬхЛ§БфЛЏКіТдВЛМЦ)ЃЌдђv(CO)=________mLЁЄmin-1ЁЃШєНЋЗДгІЦїЮТЖШНЕЕЭжС350ЁцЃЌГіПкЦјЬхжаCOЕФКЌСП________b%(ЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБ)
2CO2+N2 ЁїHЃМ0ЁЃЯжНЋКЌCOa%(ЬхЛ§ЗжЪ§ЃЌЯТЭЌ)ЁЂNO0.30%ЕФФЃФтЦћГЕЮВЦјвд100mLЁЄmin-1ЕФСїЫйЭЈЙ§450ЁцЕФЗДгІЦїЃЌГіПкЦјЬхжаCOЕФКЌСПБфЮЊb%(ЦјЬхЬхЛ§БфЛЏКіТдВЛМЦ)ЃЌдђv(CO)=________mLЁЄmin-1ЁЃШєНЋЗДгІЦїЮТЖШНЕЕЭжС350ЁцЃЌГіПкЦјЬхжаCOЕФКЌСП________b%(ЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБ)
(3)SCRММЪѕЪЧРћгУ![]() НЋЮВЦјжаЕФ
НЋЮВЦјжаЕФ![]() бЁдёадЛЙдЮЊЮоКІЦјЬхЕФММЪѕЁЃЦфжа
бЁдёадЛЙдЮЊЮоКІЦјЬхЕФММЪѕЁЃЦфжа![]() ЪЧЭЈЙ§ФђЫи[CO(NH2)2]ЗжНтЩњГЩЕФЃК
ЪЧЭЈЙ§ФђЫи[CO(NH2)2]ЗжНтЩњГЩЕФЃК
Ђё.CO(NH2)2(s)NH3(g)+HNCO(g) H1
Ђђ.HNCO(g)+H2O(g)NH3(g)+CO2(g) H2
ЂйвЛЖЈЮТЖШЯТЃЌЭљвЛКуШнУмБеШнЦїжаЭЖШызуСПЕФCO(NH2)2ЙЬЬхКЭвЛЖЈСПЕФЫЎеєЦјЃЌЗЂЩњЩЯЪіЗДгІЁЃЕБЗДгІДяЕНЦНКтЪБЃЌВтЕУc(NH3)=pmol/LЁЂc(HNCO)=qmol/LЃЌдђЗДгІЂёЕФЦНКтГЃЪ§ЮЊ________(гУКЌpЁЂqЕФБэДяЪНБэЪОЃЌЯТЭЌ)ЃЌc(CO2)=________mol/LЁЃ
ЂкЮвЙњПЦбЇМвдкбаОПЮТЖШЁЂбѕЦјХЈЖШЖдФђЫиЫЎНтВњЮяХЈЖШЕФгАЯьКѓЃЌЕУЕНШчЯТЪ§ОнЃК
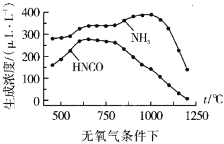
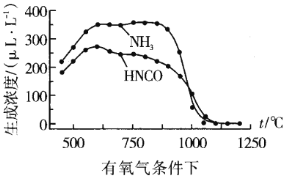
ЭЈЙ§Ъ§ОнЖдБШПЩвдЗЂЯждкгабѕЦјЁЂ1100ЁцвдЩЯЪБЃЌЬхЯЕжа![]() ХЈЖШНгНќ0ІЬLL-1ЃЌЦфПЩФмдвђЃК__
ХЈЖШНгНќ0ІЬLL-1ЃЌЦфПЩФмдвђЃК__
ЁОД№АИЁПO2 O2жаO=OМќФмБШN2жаNЁдNМќФмаЁЃЌИќвзНтРыЮЊдзг N2(g)+O2(g)=2NO(g) H=+184.0kJ/mol (a-b) ЃМ qp ![]() бѕЦјдкИпЮТЪБНЋNH3бѕЛЏ
бѕЦјдкИпЮТЪБНЋNH3бѕЛЏ
ЁОНтЮіЁП
(1)ЁїH=ЗДгІЮяЕФМќФмКЭ-ЩњГЩЮяЕФМќФмКЭЃЛ
(2) НсКЯv(CO)ЕФЕЅЮЛmLЁЄmin-1КЭЮТЖШЖдЦНКтЕФвЦЖЏЗжЮіМДПЩЃЛ
(3)ИљОнЗДгІдРэЃЌНсКЯЦНКтГЃЪ§ЕФМЦЫуЙЋЪНКЭАБЦјЕФЛЙдадЗжЮіЁЃ
(1) ЂйвбжЊO=OЕФМќФмЮЊ498.0 kJЁЄmol-1ЃЌNЁдNЕФМќФмЮЊ946.0 kJЁЄmol-1ЃЌдђO2жаO=OМќФмБШN2жаNЁдNМќФмаЁЃЌИќвзНтРыЮЊдзгЃЌЙЪЩЯЪіЛњРэжаA2ДњБэЕФЪЧO2ЃЛ
ЂквбжЊN2(g)+O2(g)=2NO(g)ЃЌдђЁїH=ЗДгІЮяЕФМќФмКЭ-ЩњГЩЮяЕФМќФмКЭ=(946.0 kJЁЄmol-1)+(498.0 kJЁЄmol-1)-2(630.0 kJЁЄmol-1)=+184.0kJ/molЃЌЙЪЭЈГЃзДПіЯТ![]() ШМЩеЩњГЩ
ШМЩеЩњГЩ![]() ЕФШШЛЏбЇЗНГЬЪНЮЊN2(g)+O2(g)=2NO(g) H=+184.0kJ/molЃЛ
ЕФШШЛЏбЇЗНГЬЪНЮЊN2(g)+O2(g)=2NO(g) H=+184.0kJ/molЃЛ
(2)ЩшЭЈЙ§ЪБМфЮЊ1minЃЌдђУПЭЈШы100mLЛьКЯЦјЬхжаКЌCOЕФЬхЛ§ЮЊamLЃЌГіПк100mLЛьКЯЦјЬхжаКЌCOЕФЬхЛ§ЮЊbmLЃЌЙЪv(CO)=![]() =(a-b)mLЁЄmin-1ЃЛвбжЊ2NO+2CO
=(a-b)mLЁЄmin-1ЃЛвбжЊ2NO+2CO![]() 2CO2+N2 ЁїHЃМ0ЃЌдђНЋЗДгІЦїЮТЖШНЕЕЭжС350ЁцЃЌЦНКтНЋе§ЯђвЦЖЏЃЌCOЕФзЊЛЏТЪЬсИпЃЌЕМжТГіПкЦјЬхжаCOЕФКЌСПЃМb%ЃЛ
2CO2+N2 ЁїHЃМ0ЃЌдђНЋЗДгІЦїЮТЖШНЕЕЭжС350ЁцЃЌЦНКтНЋе§ЯђвЦЖЏЃЌCOЕФзЊЛЏТЪЬсИпЃЌЕМжТГіПкЦјЬхжаCOЕФКЌСПЃМb%ЃЛ
(3) ЂйЕБЗДгІДяЕНЦНКтЪБЃЌВтЕУc(NH3)=pmol/LЁЂc(HNCO)=qmol/LЃЌдђЗДгІЂёЕФЦНКтГЃЪ§K=c(NH3)ЁСc(HNCO)= pq(mol/L)2ЃЛ
Щшc(CO2)=cmol/LЃЌгЩHNCO(g)+H2O(g)NH3(g)+CO2(g)ПЩжЊЗДгІжаВЮМгЗДгІЕФc(HNCO)КЭЩњГЩc(NH3)ОљЮЊcmol/LЃЌдйИљОнCO(NH2)2(s)NH3(g)+HNCO(g)ПЩжЊЗДгІжаЩњГЩc(HNCO)=c(NH3)ЃЌМДqmol/L- cmol/L= pmol/L+ cmol/LЃЌНтЕУЃКc=![]() ЃЌМДc(CO2)=
ЃЌМДc(CO2)=![]() _mol/LЃЛ
_mol/LЃЛ
ЂкЭЈЙ§БШНЯЮТЖШЁЂбѕЦјХЈЖШЖдФђЫиЫЎНтВњЮяХЈЖШЕФгАЯьКѓЃЌЗЂЯждкгабѕЦјЁЂ1100ЁцвдЩЯЪБЃЌЬхЯЕжа![]() ХЈЖШНгНќ0ІЬLL-1ЃЌЦфПЩФмдвђЪЧАБЦјгаЛЙдадЃЌдкИпЮТЯТФмБЛбѕЦјбѕЛЏЁЃ
ХЈЖШНгНќ0ІЬLL-1ЃЌЦфПЩФмдвђЪЧАБЦјгаЛЙдадЃЌдкИпЮТЯТФмБЛбѕЦјбѕЛЏЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГбаОПаЁзщвдЗМЯузхЛЏКЯЮяAЮЊжївЊдСЯЃЌАДЯТСаЯпТЗКЯГЩПЙёВ№явЉЮяWЃК

вбжЊЃК![]()
ЧыЛиД№ЃК
ЃЈ1ЃЉЯТСаЫЕЗЈе§ШЗЕФЪЧ________ЁЃ
A.ЗДгІЂкЪЧбѕЛЏЗДгІ B.ЪдМСXЪЧХЈЯѕЫсКЭХЈСђЫс
C.ЗДгІЂлЂнЕФФПЕФЪЧБЃЛЄ![]() D.вЉЮяWЕФЗжзгЪНЪЧ
D.вЉЮяWЕФЗжзгЪНЪЧ![]()
ЃЈ2ЃЉаДГіЛЏКЯЮяCЕФНсЙЙМђЪН________ЁЃ
ЃЈ3ЃЉаДГіЗДгІЂоЕФЛЏбЇЗНГЬЪН________ЁЃ
ЃЈ4ЃЉЩшМЦДгGЕНHЕФКЯГЩТЗЯпЃЈгУСїГЬЭМБэЪОЃЌЮоЛњЪдМСШЮбЁЃЉ________ЁЃ
ЃЈ5ЃЉаДГіЛЏКЯЮяAЕФЯрСкЭЌЯЕЮяYЕФЭЌЗжвьЙЙЬхНсЙЙМђЪНЃЌЧвБиаыЗћКЯЯТСаЬѕМўЃК________ЁЃ
ЂйФмЗЂЩњвјОЕЗДгІЃЛ
Ђк![]() БэУїЃЌЗжзгжаЙВга4жжHдзгЃЛ
БэУїЃЌЗжзгжаЙВга4жжHдзгЃЛ
ЂлГ§СЫБНЛЗЮоЦфЫќЛЗЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњЦНдЕиЧјЕиЯТЫЎжЪСПВюЃЌЬњЁЂУЬКЌСПНЯИпЃЌашНјааДІРэВХФмДяЕНвћгУЫЎБъзМЁЃЕиЯТЫЎжаЬњУЬЕФРДдДжївЊЪЧПѓЮяFeCO3КЭMnCO3ЁЃ
(1)ЫсгъЕиЧјЕиЯТЫЎжаЬњКЌСПИќИпЃЌНсКЯЛЏбЇгУгяДгЦНКтвЦЖЏНЧЖШНтЪЭдвђ_______ЁЃ
(2)ШЅГ§Fe2+
ЂйГ§ЬњТЫГиОЙ§ЦиЦј3ЁЋ7ЬьКѓЃЌТЫСЯБэУцаЮГЩ______ЩЋЮяжЪЃЌЦфГЩЗжЪЧFe(OH)3ЃЌЪЙЕУШмвКжаFe2+КЌСПбИЫйЯТНЕЃЌЦфзїгУЙ§ГЬШчЭМЫљЪОЁЃ
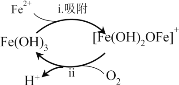
ЂкНЋЙ§ГЬiiЕФРызгЗНГЬЪНВЙГфЭъећЃК________ЁЃ
Й§ГЬiЃКFe2++Fe(OH)3=[Fe(OH)2OFe]++H+
Й§ГЬiiЃК4[Fe(OH)2OFe]++ +10H2O= +
ЂлгаРћгкЬсИпЙ§ГЬiiЗДгІЫйТЪЕФДыЪЉЪЧ______(ЬюађКХ)ЁЃ
A. НЕЕЭЮТЖШ B. ЭЈШызуСПO2 C. НСАш
(3)ШЅГ§Mn2+
ЯђГ§УЬТЫГижаМгШыClO2НЋMn2+бѕЛЏЮЊMnO2ЃЌЫцзХЗДгІНјааЃЌТЫГиШмвКЕФpH___(ЬюЁАБфДѓЁБЁАБфаЁЁБЛђЁАВЛБфЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИљОнЯТСаСНИіШШЛЏбЇЗНГЬЪНЃЌЛиД№ЯТСаЮЪЬтЃК
2H2(g)+O2(g)![]() 2H2OЃЈ1ЃЉ ІЄH=571.6 kJ ЁЄ mol1
2H2OЃЈ1ЃЉ ІЄH=571.6 kJ ЁЄ mol1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ІЄH=2 220 kJ ЁЄ mol1
3CO2(g)+4H2O(l) ІЄH=2 220 kJ ЁЄ mol1
ЃЈ1ЃЉH2ЕФШМЩеШШЮЊ_______ЃЌC3H8ЕФШМЩеШШЮЊ_______ЁЃ
ЃЈ2ЃЉ1 mol H2КЭ2 mol C3H8зщГЩЕФЛьКЯЦјЬхЭъШЋШМЩеЪЭЗХЕФШШСПЮЊ______________ЁЃ
ЃЈ3ЃЉЯжгаH2КЭC3H8ЕФЛьКЯЦјЬхЙВ5 molЃЌЭъШЋШМЩеЪБЗХШШ3 847 kJЃЌдђдкЛьКЯЦјЬхжаH2КЭC3H8ЕФЬхЛ§БШЪЧ_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСабѕЛЏЛЙдЗДгІжаЃЌЕчзгзЊвЦЕФЗНЯђКЭЪ§ФПОље§ШЗЕФЪЧЃЈ ЃЉ
A.
B.
C.
D.
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУ14.2gЮоЫЎСђЫсФЦХфжЦГЩ500mLШмвК,ЦфЮяжЪЕФСПХЈЖШЮЊ__________molL-1ЁЃШєДгжаШЁГі50 mLЃЌЦфЮяжЪЕФСПХЈЖШЮЊ__________ molL-1ЁЃШєНЋет50 mLШмвКгУЫЎЯЁЪЭЕН100 mL,ЫљЕУШмвКжа![]() ЕФЮяжЪЕФСПХЈЖШЮЊ__________ molL-1ЃЌ
ЕФЮяжЪЕФСПХЈЖШЮЊ__________ molL-1ЃЌ![]() ЕФЮяжЪЕФСПХЈЖШЮЊ__________ molL-1ЁЃ
ЕФЮяжЪЕФСПХЈЖШЮЊ__________ molL-1ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвјАзЩЋЙЬЬхA:ЂйЗХдкПеЦјжаПЩбѕЛЏЩњГЩАзЩЋЙЬЬхBЃЛЂкНЋAЕуШМЃЌЛ№бцГЪЛЦЩЋЃЌЩњГЩЕЛЦЩЋЙЬЬхCЃЛЂлAЁЂBЁЂCОљПЩгыЮоЩЋвКЬхDЗДгІЃЌЩњГЩМюадЮяжЪEЃЌЦфжаAИњDЗДгІЪБЛЙПЩвдЩњГЩПЩШМадЦјЬхFЃЌCИњDЗДгІдђЩњГЩСэвЛжжЦјЬхGЃЛЂмFКЭGЛьКЯКѓгіЛ№ПЩОчСвЗДгІЖјЗЂЩњБЌеЈЃЌВЂЩњГЩDЁЃОнДЫХаЖЯ:
ЃЈ1ЃЉA______ЃЌB______ЃЌC______ЃЌD________ЃЌE____ЃЌF_______ЃЌG_______ЁЃЃЈЬюЛЏбЇЪНЃЉ
ЃЈ2ЃЉаДГігаЙиЗДгІЕФЛЏбЇЗНГЬЪН:
Ђй___________________________________________ЁЃ
Ђк__________________________________________ЁЃ
Ђл__________________________________________ЁЃ
Ђм__________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПИжЬњЁАЗЂРЖЁБЪЧжИдкИжЬњЕФБэУцаЮГЩвЛВуЫФбѕЛЏШ§ЬњЕФММЪѕЙ§ГЬЁЃЦфжаЕквЛВНЗДгІЮЊЃК3Fe+ NaNO2+ 5 NaOH= 3Na2FeO2+ H2O+ NH3ЁќЁЃЙигкИУЗДгІЫЕЗЈе§ШЗЕФЪЧ![]()
A.ЗДгІжаNдЊЫиБЛбѕЛЏ
B.NaFeO2МШЪЧбѕЛЏВњЮявВЪЧЛЙдВњЮя
C.ећИіЗДгІЙ§ГЬжаУПга![]() ВЮМгЗДгІОЭзЊвЦ
ВЮМгЗДгІОЭзЊвЦ![]() Ечзг
Ечзг
D.бѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ3:1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШ§ТШЛЏЕт(ICl3)дквЉЮяКЯГЩжагУЭОЗЧГЃЙуЗКЃЌЦфШлЕуЃК33ЁцЃЌЗаЕуЃК73ЁцЃЌгіЫЎвзЗДгІЁЃЪЕбщЪвПЩгУЯТЭМзАжУ(ВПЗжМаГжзАжУвбТдШЅ)жЦШЁICl3ЃЌжЦБИЕФЗДгІдРэЃК![]() ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
ЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
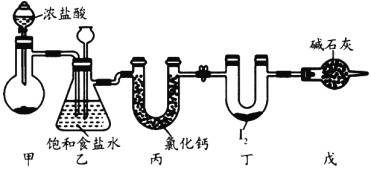
A.РћгУзАжУМзжЦБИТШЦјбЁгУЕФвЉЦЗЮЊЖўбѕЛЏУЬКЭХЈбЮЫс
B.зАжУввжаГЄОБТЉЖЗвКУцЩЯЩ§ЫЕУїБћзАжУПЩФмЗЂЩњЖТШћ
C.зАжУБћжаТШЛЏИЦЕФзїгУЪЧИЩдяCl2
D.зАжУЖЁжаЩњГЩICl3ЃЌЕтдЊЫиЕФЛЏКЯМлЮЊ-3Мл
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com