
【题目】苯硫酚(C6H5-SH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(C6H5-Cl)和硫化氢(H2S)反应来制备苯硫酚,但会有副产物苯(C6H6) 生成。
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) △H2
S8(g) △H2
反应II的焓变不易测量,现查表得如下数据:
Ⅲ: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) △H3=-29.0 kJ/mol
S8(g) △H3=-29.0 kJ/mol
请回答:
(1)反应II为不可逆反应,请简述理由______________。
(2)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图1和图2。
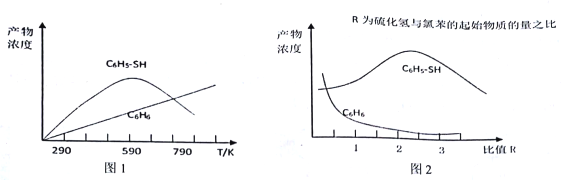
①下列说法不正确的是____________。
A.由图1可知,相同条件下反应I的活化分子百分数大于反应II 的活化分子百分数
B.图1中C6H5-SH 的浓度在590℃随温度变化的原因可能是反应II 中消耗反应物,使反应I平衡逆向移动
C.其他条件不变,由图1可知,氯苯的转化率随温度的升高而降低
D.由图2 可知,若要提高C6H5-SH 的产量,可提高硫化氢与氯苯起始物质的量之比
②590℃时,氯苯和硫化氢混合气体(体积比1:2.5,总物质的量amol)在VL的固定容积中进行反应,达到平衡时,测得容器中苯硫酚的物质的量为a/7mol,苯的物质的量为a/l4mol,则该温度下反应I的平衡常数为____。(保留两位有效数字)
③请根据图1、图2,在右图中画出恒温恒容条件下反应主产物苯硫酚的物质的量浓度随时间变化的曲线图________

(3)除了用以上方法制备苯硫酚以外,亦可电解还原苯磺酸(C6H5-SO3H,一元强酸)或苯磺酰氯来制备。以锌和石墨为电极,硫酸为电解质溶液,电解苯磺酸时的阴极反应式为_______。
【答案】 反应II △H2=-45.8kJ/mol<0,△S>0,说明其正反应是自发反应,而逆反应为非自发反应,所以反应II为不可逆反应 CD 0.86 如图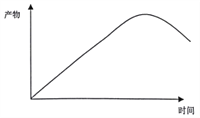 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O
C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O
【解析】(1)本题考查热化学反应方程式的计算、化学反应进行的方向,根据III,II-I,得出△H3=△H2-△H1,求出△H2=-45.8kJ·mol-1,根据△G=△H-T△S,因为△H2<0,△S>0,说明其正反应是自发进行,而逆反应为非自发进行;(2)本题考查化学反应条件的控制、化学平衡常数的计算,①A、根据图①反应I的化学反应速率比反应II快,说明相同条件下,反应I的活化分子百分数大于反应II活化分子百分数,故A说法正确;B、根据反应I和反应II的化学反应方程式,氯苯和硫化氢都是反应物,因为反应II是不可逆反应,升高温度,反应II中消耗氯苯和硫化氢,相当于减少反应I中反应物的浓度,平衡向逆反应方向进行,苯硫酚的浓度降低,故B说法正确;C、根据图1,反应II中氯苯的转化率随温度的升高而升高,故C说法错误;D、根据图2,在提高硫化氢与氯苯起始物质的量之比时,苯硫酚的浓度反而降低,故D说法错误;②C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g)
C6H5-SH(g)+HCl(g)
变化物质的量: a/7 a/7 a/7 a/7
C6H5-Cl(g)+H2S(g)===C6H6(g)+HCl(g)+ ![]() S8(g)
S8(g)
变化的物质的量: a/14 a/14 a/14 a/14 开始时,氯苯的总物质的量为![]() ,硫化氢总物质的量为
,硫化氢总物质的量为![]() ,达到平衡时,氯苯的物质的量为
,达到平衡时,氯苯的物质的量为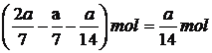 ,硫化氢物质的量为
,硫化氢物质的量为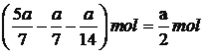 ,根据化学平衡常数的表达式,K=
,根据化学平衡常数的表达式,K=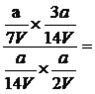 0.86;③根据图1和图2,随着反应的进行苯硫酚的浓度增加,然后降低,因此图像是
0.86;③根据图1和图2,随着反应的进行苯硫酚的浓度增加,然后降低,因此图像是 ;(3)本题考查电极反应式的书写,根据电解原理,阴极上得到电子,化合价降低,发生还原反应,环境是酸性,因此电极反应式为 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O。
;(3)本题考查电极反应式的书写,根据电解原理,阴极上得到电子,化合价降低,发生还原反应,环境是酸性,因此电极反应式为 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O。


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】最简式相同,但既不是同系物,又不是同分异构体的是
A. 辛烯和3-甲基-1-丁烯 B. 苯和乙炔
C. 1-氯丙烷和2-氯丙烷 D. 甲基环己烷和庚烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应4CO+2NO2![]() N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最快的是( )
A. υ(CO)=1.5 mol·L-1·min-1 B. υ(NO2)=0.7 mol·L-1·min-1
C. υ(N2)=0.4 mol·L-1·min-1 D. υ(CO2)=1.1 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂周围的空气含有较多二氧化硫,某化学兴趣小组设计了以下装置和方法测定空气(内含N2、O2、SO2、CO2等)中SO2含量。
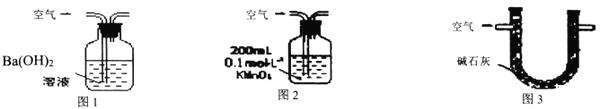
甲.用图1所示装置,通入V升空气,测定生成沉淀的质量
乙.用图2所示装置,当KMnO4溶液刚好褪色时,测定通入空气的体积V
丙.用图3所示装置,通入V升空气,测定U型管增加的质量
(1)你认为可行的操作是________。(填“甲、乙、丙”)
(2)某环保部门为了测定空气中SO2含量,做了如下实验:取标准状况下的空气VL,缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①若通入气体的速率过快,则测定的SO2的体积分数_______。(选填“偏高”、“偏低”或“不受影响”)。
②如何判断氯化钡溶液已经加过量_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列电解质在水溶液中的电离方程式
NaHCO3__________________________
HCl____________________________
CH3COOH_________________________
Fe(OH)3_______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式为 HO-CH2CH=CHCH2-COOH ,该有机物不可能发生的化学反应是 ( )
A. 水解B. 酯化C. 加成D. 氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+

①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.二氧化硅既不溶于水也不溶于任何酸
B.二氧化碳通入饱和氯化钙溶液中能生成白色沉淀
C.二氧化碳通入硅酸钠溶液中可以得到硅酸
D.二氧化硅是制造玻璃的主要原料,它不能与氢氧化钠溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com