
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
【答案】B
【解析】分析浓度变化关系:X(g)+3Y(g)![]() 2Z(g)
2Z(g)
c起始/(mol/L) c1 c2 c3
c改变/(mol/L) c1-0.1 c2-0.3 0.08- c3
c平衡/(mol/L) 0.1 0.3 0.08
反应的化学方程式中反应物化学计量数之比为1∶3,所以反应中X和Y必然以1∶3消耗,因为达平衡时X和Y浓度之比为1∶3,故c1∶c2=1∶3,选项A合理;平衡时Y和Z的生成速率之比应该和化学方程式对应化学计量数之比相等,故Y和Z的生成速率之比为3∶2,选项B不合理;由于起始时反应物是按化学方程式化学计量数之比配料,故X和Y转化率相等,选项C合理;运用极限法,假设Z完全转化为反应物,c1的极限值为0.14 mol/L,而题设c1>0,反应又是可逆的,选项D合理。答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边溶液中同时各滴入几滴酚酞溶液,请回答以下问题:
①X极上的电极反应式是______________________________________________________。
②电解NaCl溶液的离子方程式是____________________________________________。
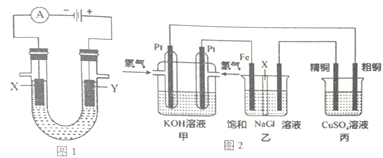
(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为______________________________________________________________。
②石墨电极(乙装置中右侧电极)为__________极(填“阳”或“阴”),反应一段时间后,在乙装置中滴入酚酞溶液,__________极区(填“铁”或“石墨”)的溶液变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”、“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为__________L;丙装置中阴极析出铜的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以电石渣(主要成分为Ca(OH)2和CaCO3)为原料制备KClO3的流程如下:
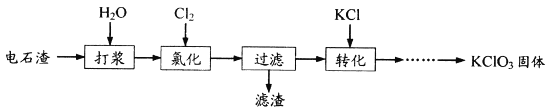
下列说法不正确的是
A. 氯化过程中主反应为:6Ca(OH)2+6Cl2= Ca(ClO3)2+5CaCl2+6H2O
B. 适当减缓通Cl2速率,充分搅拌浆料,加水使Ca(OH)2完全溶解,均有利于氯气的吸收
C. 滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n[CaCl2]=1:5
D. 向滤液中加入稍过量KC1固体可将Ca(ClO3)2转化为KClO3,通过蒸发浓缩、冷却结晶的方法析出KClO3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯硫酚(C6H5-SH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(C6H5-Cl)和硫化氢(H2S)反应来制备苯硫酚,但会有副产物苯(C6H6) 生成。
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) △H2
S8(g) △H2
反应II的焓变不易测量,现查表得如下数据:
Ⅲ: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) △H3=-29.0 kJ/mol
S8(g) △H3=-29.0 kJ/mol
请回答:
(1)反应II为不可逆反应,请简述理由______________。
(2)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图1和图2。
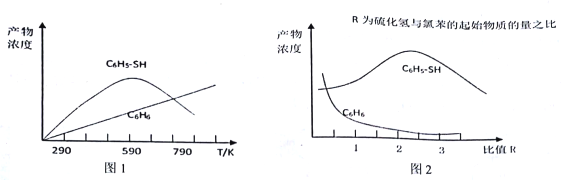
①下列说法不正确的是____________。
A.由图1可知,相同条件下反应I的活化分子百分数大于反应II 的活化分子百分数
B.图1中C6H5-SH 的浓度在590℃随温度变化的原因可能是反应II 中消耗反应物,使反应I平衡逆向移动
C.其他条件不变,由图1可知,氯苯的转化率随温度的升高而降低
D.由图2 可知,若要提高C6H5-SH 的产量,可提高硫化氢与氯苯起始物质的量之比
②590℃时,氯苯和硫化氢混合气体(体积比1:2.5,总物质的量amol)在VL的固定容积中进行反应,达到平衡时,测得容器中苯硫酚的物质的量为a/7mol,苯的物质的量为a/l4mol,则该温度下反应I的平衡常数为____。(保留两位有效数字)
③请根据图1、图2,在右图中画出恒温恒容条件下反应主产物苯硫酚的物质的量浓度随时间变化的曲线图________

(3)除了用以上方法制备苯硫酚以外,亦可电解还原苯磺酸(C6H5-SO3H,一元强酸)或苯磺酰氯来制备。以锌和石墨为电极,硫酸为电解质溶液,电解苯磺酸时的阴极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:
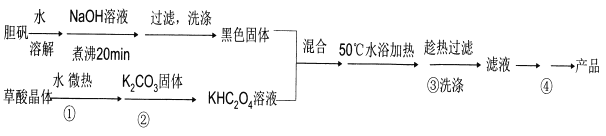
(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。
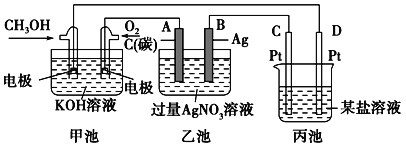
(1)甲池中OH-移向__________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式_______________。
(3)乙池中总反应的离子方程式___________________。
(4)当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的pH是___________;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________(填序号)。
A. MgSO4 B. CuSO4 C. NaCl D. AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的SO2和SO3,它们之间的关系正确的是
A. 所含硫原子的物质的量之比为1:1 B. 所含氧原子的物质的量之比为3:2
C. 氧元素的质量比为6: 5 D. 硫元素的质量比为5:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com