
【题目】(1)图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边溶液中同时各滴入几滴酚酞溶液,请回答以下问题:
①X极上的电极反应式是______________________________________________________。
②电解NaCl溶液的离子方程式是____________________________________________。
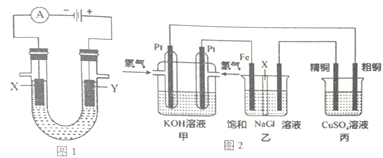
(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为______________________________________________________________。
②石墨电极(乙装置中右侧电极)为__________极(填“阳”或“阴”),反应一段时间后,在乙装置中滴入酚酞溶液,__________极区(填“铁”或“石墨”)的溶液变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”、“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为__________L;丙装置中阴极析出铜的质量为__________g。
【答案】 2H++2e-= H2↑ 2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH- H2-2e-+ 2OH-═ 2H2O 阳 铁 减小 0.448 1.28
Cl2↑+ H2↑+ 2OH- H2-2e-+ 2OH-═ 2H2O 阳 铁 减小 0.448 1.28
【解析】(1)①X极为阴极,溶液中H+得电子发生还原反应,正确答案:2H++2e-= H2↑;
②惰性电极电解饱和食盐水,阴极产生氢气和氢氧化钠溶液,阳极产生氯气;正确答案:2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-;
Cl2↑+ H2↑+ 2OH-;
(2)①通入氢气电极为原电池的负极,在碱性环境下氢气失电子发生氧化反应,正确答案:H2-2e-+ 2OH-═ 2H2O;
②通入氢气的一极为原电池的负极,铁电极为电解池的阴极,所以乙装置中右侧电极为阳极;正确答案:阳;电解饱和食盐水,阴极产生氢气,氢离子浓度减少,氢氧根离子浓度增大,碱性增强,滴入酚酞,铁电极附近溶液变红;正确答案:铁;
③如果粗铜中含有锌、银等杂质,锌的活泼性比铜强,先于铜失电子,发生氧化反应,硫酸铜溶液中铜离子得电子,在阴极被还原出来,导致溶液中硫酸铜溶液浓度将减少;正确答案:减少;
④ 串联电路电子转移数目相等;1mol氧气转移4mol电子,224mL氧气参加反应共转移电子0.04mol,阴极铁附近,极反应:2H++2e-= H2↑, 产生氢气0.02mol,,体积为 0.448L;正确答案:0.448;丙中阴极极反应为Cu2++2e-=Cu,产生金属铜0.02 mol,质量为1.28 g;正确答案:1.28;


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】某学生欲用0.100 0 mol·L-1的盐酸来滴定未知浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用0.100 0 mol·L-1的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到因加入一滴盐酸后,溶液由红色变为无色,且____________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为____________mL,终点读数为____________mL。

(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 氢氧化钠溶液/mL | 0.100 0 mol·L-1 盐酸的体积(mL) | ||
滴定前 | 滴定后 | 消耗 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氯气都有漂白性,现把二者以等物质的量混合,让混合气体通入品红溶液,则其漂白性将( )
A.和氯气单独通过时相同B.和二氧化硫单独通过时相同
C.是二者作用效果之和D.可能失去漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最简式相同,但既不是同系物,又不是同分异构体的是
A. 辛烯和3-甲基-1-丁烯 B. 苯和乙炔
C. 1-氯丙烷和2-氯丙烷 D. 甲基环己烷和庚烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:

(1)3种试剂的化学式:A______,B______,C______。
(2)加过量A的原因是___________________________________________________________,有关反应的化学方程式为________________________________________________________________。
(3)加过量B的原因是______________________________________________________,有关反应的化学方程式为_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 1mol—CH3中含有的质子数为10NA
B. H2O2+Cl2=2HC1+O2反应中,每生成32g O2转移2NA个电子
C. 3.6gCO和 CO2的混合气体含中子数为1.8NA
D. 6.2g 白磷含有0.3NAP-P键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com