
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:

(1)3种试剂的化学式:A______,B______,C______。
(2)加过量A的原因是___________________________________________________________,有关反应的化学方程式为________________________________________________________________。
(3)加过量B的原因是______________________________________________________,有关反应的化学方程式为_____________________________________________________________。
【答案】Ba(OH)2 K2CO3 稀盐酸为了除尽Mg2+、SO![]() MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓为了除尽过量的Ba2+Ba(OH)2+K2CO3===2KOH+BaCO3↓,BaCl2+K2CO3===BaCO3↓+2KCl
MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓,MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓为了除尽过量的Ba2+Ba(OH)2+K2CO3===2KOH+BaCO3↓,BaCl2+K2CO3===BaCO3↓+2KCl
【解析】
试题除去KCl溶液中少量的MgCl2、MgSO4,为防止引入杂质,Na2CO3和Ba(NO3)2是不能使用的。应先加入稍过量的Ba(OH)2,把MgCl2和MgSO4完全沉淀,然后再加入稍过量的K2CO3除去过量的Ba(OH)2,过滤后,向滤液中加入稀盐酸除去过量的K2CO3。
(1)3种试剂的化学式:A、Ba(OH)2,B、K2CO3,C、稀盐酸。
(2)加过量Ba(OH)2的原因是为了除尽Mg2+、SO42-,有关反应的化学方程式MgCl2+Ba(OH)2===BaCl2+Mg(OH)2↓、MgSO4+Ba(OH)2===BaSO4↓+Mg(OH)2↓。
(3)加过量K2CO3的原因是为了除尽过量的Ba2+,有关反应的化学方程式为Ba(OH)2+K2CO3=2KOH+BaCO3↓、BaCl2+K2CO3===BaCO3↓+2KCl


科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中充入4moIX,当反应4X(g)3Y(g)+Z(g)达到平衡状态时,有30%的X发生分解,则达到平衡状态时混合气体的总物质的量是( )
A.4mol
B.3.4mol
C.2.8mol
D.1.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一定条件下,向A、B两个恒容密闭容器中分别加入等量的X(容器内所有物质均为气体),测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法正确的是
A. A.B容积相同,但反应温度不同.且温度:A>B
B. A、B反应温度相同,但容积不同,且容积:A>B
C. a,b,c三点对应的平均相对分子质量:b>c>a
D. t2-t3时间段内,A、B两容器中平均反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
香料E的合成路线如下:
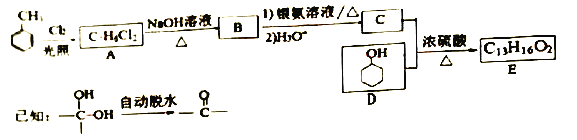
(l) B的化学名称是____。D中官能团的名称为_____。
(2)C和D生成E的反应类型为____.E的结构简式为______。
(3)1molB与足量银氨溶液反应生成____g Ag;A的核磁共振氢谱有_____个峰。
(4)同时满足下列条件的C的同分异构体有______种(不含立体异构)。
①遇FeC13溶液发生显色反应 ②能发生银镜反应
用D合成一种催眠药I的合成路线如下:
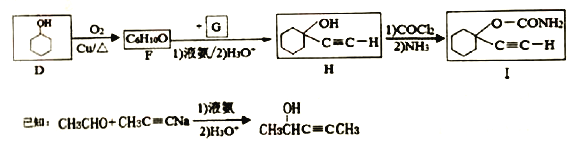
(5)D生成F的化学方程式为______________
(6)以乙炔和甲醛为起始原料。选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系.箭头上注明试剂和反应条件)__________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系.箭头上注明试剂和反应条件)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边溶液中同时各滴入几滴酚酞溶液,请回答以下问题:
①X极上的电极反应式是______________________________________________________。
②电解NaCl溶液的离子方程式是____________________________________________。
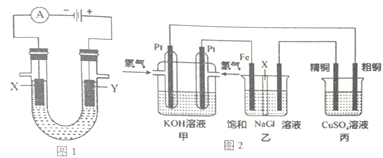
(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为______________________________________________________________。
②石墨电极(乙装置中右侧电极)为__________极(填“阳”或“阴”),反应一段时间后,在乙装置中滴入酚酞溶液,__________极区(填“铁”或“石墨”)的溶液变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”、“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为__________L;丙装置中阴极析出铜的质量为__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3H、14C、14N、16O、32S等在科学研究中应用广泛,下列对它们的说法正确的是( )
A.3H的核外电子数比2H多一个
B.16O和32S原子核内的中子数相等
C.14C和14N互称为同位素
D.32S原子核内的质子数为16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的能量图,下列说法正确的是
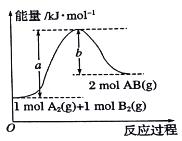
A. A2(g)+B2(g)=2AB(g)是一个放热反应
B. 2molAB的总能量大于1molA2和lmolB2的能量之和
C. 1molA2(g)和1molB2(g)的能量之和为akJ
D. 2AB(g)=A2(l)+B2(l)△H<(b-a)kJ/mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和锌的混合物共31.6克,与足量稀硫酸反应,产生标准状况下氢气11.2 升,
问:①产生标准状况下氢气的物质的量是多少?__________
②混合物中锌的物质的量是多少___________?铁的质量是多少?___________
③参与反应的硫酸物质的量是多少?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:
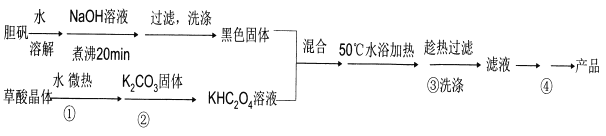
(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com