
【题目】一定温度下,在密闭容器中充入4moIX,当反应4X(g)3Y(g)+Z(g)达到平衡状态时,有30%的X发生分解,则达到平衡状态时混合气体的总物质的量是( )
A.4mol
B.3.4mol
C.2.8mol
D.1.2mol
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】硼普遍存在于蔬果中,是维持骨的健康和钙、磷、镁正常代谢所需要的微量元素之一。回答下列问题:
(1)硼原子核外电子占据最高能层的符号是__________,占据最高能级的电子云轮廓图形状为___________。价层电子的轨道表达式(电子排布图)为____________。
(2)硼原子的第二电高能(I2)和第三电离能(I3)的大小关系为:I2______I3(填“>”或“<”),原因是____________。
(3)BF3可用于制造火箭的高能燃料。其分子构型为___________,已知BF3分子中F原子和B原子采用同种杂化方式为____________,BF3分子还中存在大π键,可用符号![]() 表示(其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为
表示(其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,如苯分子中的大π键可表示为![]() ),则分子中的大π键应表示为____________。
),则分子中的大π键应表示为____________。
(4)硼酸(H3BO3)晶体为层状结构。其中一层的结构片段如图(a)所示,将这些H3BO3分子聚集在一起的作用为____________。
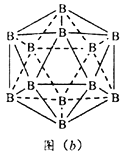
(5)晶体拥有多种变体,但其基本结构单元都是由硼原子组成的正二十面体,如图(b),每个顶点为个硼原子,构成的三角形均为等边三角形,若该结构单元中有10个原子为10B(其余为11B),那么该结构单元有_________种不同类型。
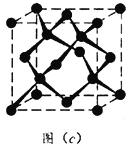
(6)立方氮化硼(BN)晶体与金刚石晶体互为等电子体,图(c)为金刚石晶体的晶胞,立方氮化硼晶体可以取出多种晶胞。其中一种晶胞中N全部位于晶胞体内,则B处于____________位置。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________________。
(4)判断BaCl2已过量的方法是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用0.100 0 mol·L-1的盐酸来滴定未知浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用0.100 0 mol·L-1的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到因加入一滴盐酸后,溶液由红色变为无色,且____________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为____________mL,终点读数为____________mL。

(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 氢氧化钠溶液/mL | 0.100 0 mol·L-1 盐酸的体积(mL) | ||
滴定前 | 滴定后 | 消耗 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.酸性:H2SO4 > HClO4B.半径:r(Na+) > r(S2-)
C.稳定性:PH3 < H2OD.碱性:Ba(OH)2 < Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子晶体中一定存在共价键和范德华力
B.由非金属元素组成的化合物一定是共价化合物
C.原子晶体和分子晶体一定均含有共价键,离子晶体也可能含有共价键
D.两个非金属元素原子间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种应用广泛的化工产品,可用于合成抗生素头孢菌素药物的中间体,汽车安全气囊等。回答下列问题:
Ⅰ.实验室制备NaN3
水合肼(N2H4·H2O) 与亚硝酸甲酯(CH3ONO)在氢氧化钠存在下制备NaN3,其反应装置如图所示:
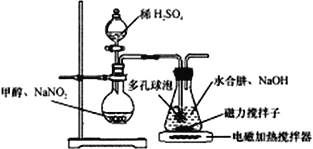
已知:2CH3OH+2NaNO2+H2SO4→2CH3ONO+ Na2SO4+2H2O; NaN3无色无味,微溶于醇、溶于水
(1)N2H4的电子式为_______________;NaN3晶体中阴离子与阳离子个数比为______________。
(2)装置中多孔球泡的作用是___________________。
(3)锥形瓶中水合肼与亚硝酸甲酯在30℃时可以反应生成叠氮酸钠、甲醇等物质,写出该反应的化学方程式_______________________________。
Ⅱ.回收甲醇
将制备反应后所得混合溶液加入烧瓶中,按照下图所示装置进行减压蒸馏。
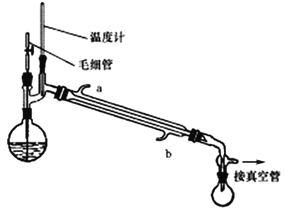
已知:
物质 | CH3OH | N2H4 | NaN3 |
沸点/℃ | 64.7 | 113.5 | 300 |
NaN3在40℃时分解
(4)实验时冷凝管中冷却水要“b进a出”原因是______________________。
(5)甲醇回收时需用减压蒸馏的原因是________________________。
(6)下列有关毛细管的作用说法正确的是_______________。
A.平衡圆底烧瓶内外压 B.作为气化中心,使蒸馏平稳
C.避免液体过热而暴沸 D.冷凝回流作用
Ⅲ.产品提取及纯度测定
将蒸馏后所得母液降温结晶,过滤得NaN3湿品;再用去离子水重结晶得NaN3产品并用碘量法测定产品纯度。取产品6.50g加入足量去离子水中溶解,并加入适量稀硫酸酸化;向混合液中加入20.00mL 1.00mol·L-lKMnO4溶液,溶液呈紫红色;再加入足量KI溶液消耗过量的KMnO4溶液;其后用0.100mol·L-lNa2S2O3标准溶液滴定所产生的I2,消耗Na2S2O3溶液30.00mL。
(7)实验所得产品的纯度为______________________。
已知:①产品中杂质不参与反应;
②测定过程中发生的反应:
10NaN3+2KMnO4+8H2SO4==2MnSO4+K2SO4+5Na2SO4+8H2O+15N2↑;
10KI+2KMnO4+8H2SO4==2MnSO4+6K2SO4+8H2O+5I2;
I2+2Na2S2O3==2NaI +Na2S4O6。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:

(1)3种试剂的化学式:A______,B______,C______。
(2)加过量A的原因是___________________________________________________________,有关反应的化学方程式为________________________________________________________________。
(3)加过量B的原因是______________________________________________________,有关反应的化学方程式为_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com