
【题目】相同质量的SO2和SO3,它们之间的关系正确的是
A. 所含硫原子的物质的量之比为1:1 B. 所含氧原子的物质的量之比为3:2
C. 氧元素的质量比为6: 5 D. 硫元素的质量比为5:4
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 1mol—CH3中含有的质子数为10NA
B. H2O2+Cl2=2HC1+O2反应中,每生成32g O2转移2NA个电子
C. 3.6gCO和 CO2的混合气体含中子数为1.8NA
D. 6.2g 白磷含有0.3NAP-P键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属元素R的最高价氧化物的水化物是HnRO2n-2,则在气态氢化物中R元素的化合价是:( )
A.3n-10B.12-3nC.3n-4D.3n-12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+

①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某次实验需用80mL、3mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为________。
(2)配制80mL、3mol/L 的稀H2SO4溶液,则需取98%的浓H2SO4________mL,量取浓硫酸所用的量筒的规格是________(从下列中选用)A.10mL B.25mL C.50mL D.100mL
(3)将下列步骤中的空格补充填写完整
①用量筒量取所需的浓硫酸
②将烧杯中的溶液__________________________________________________
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复至室温
⑤向容量瓶中加入蒸馏水_____________________________________________
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀.
(4)实验中上述步骤的正确排序为________(填序号)
(5)下列各种情况使所配制溶液浓度偏高的__________________
A.未经冷却趁热将溶液注入容量瓶中
B将量筒中残留的浓硫酸洗涤后.转移入容量瓶中
C.定容时仰视液面读数
D量取浓硫酸时俯视读数
(6)取用任意体积的所配3mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是_______(填字母)
A、溶液中H2SO4的物质的量 B、溶液的浓度 C、溶液中SO42的数目D、溶液的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素位于周期表中的ⅣA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属元素.此元素可能是( )
A.Si
B.Ge
C.Sn
D.Pb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
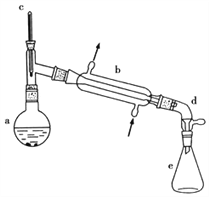

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
(1)合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
(2)分离提纯:
反应粗产物倒入分液漏斗中,分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称____________
(2)如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是_________(填正确答案标号)
A.立刻补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________
(4)在本实验的分离过程中,产物应从分液漏斗的_________________(填“上口倒出”或“下口倒出”)
(5)分离提纯过程中加入无水氯化钙的目的是________________________
(6)在蒸馏收集产品时, 控制的温度应在____________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是______________(填序号)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com