
【题目】某次实验需用80mL、3mol/L 的稀H2SO4溶液,某同学用98%的浓H2SO4(ρ=1.84g/cm3)进行配制,请回答下列问题:
(1)98%的浓H2SO4(ρ=1.84g/cm3)的物质的量浓度为________。
(2)配制80mL、3mol/L 的稀H2SO4溶液,则需取98%的浓H2SO4________mL,量取浓硫酸所用的量筒的规格是________(从下列中选用)A.10mL B.25mL C.50mL D.100mL
(3)将下列步骤中的空格补充填写完整
①用量筒量取所需的浓硫酸
②将烧杯中的溶液__________________________________________________
③将浓硫酸缓缓注入盛有适量蒸馏水的烧杯中,边加边搅拌
④将溶液冷却,恢复至室温
⑤向容量瓶中加入蒸馏水_____________________________________________
⑥盖好瓶塞,反复上下颠倒,摇匀
⑦洗涤烧杯2~3次,洗涤液也注入容量瓶中.轻轻摇动容量瓶,使溶液混合均匀.
(4)实验中上述步骤的正确排序为________(填序号)
(5)下列各种情况使所配制溶液浓度偏高的__________________
A.未经冷却趁热将溶液注入容量瓶中
B将量筒中残留的浓硫酸洗涤后.转移入容量瓶中
C.定容时仰视液面读数
D量取浓硫酸时俯视读数
(6)取用任意体积的所配3mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是_______(填字母)
A、溶液中H2SO4的物质的量 B、溶液的浓度 C、溶液中SO42的数目D、溶液的密度
【答案】18.4mol/L16.3mlB用玻璃棒引流转移入100mL容量瓶中至距离刻度线1-2cm处,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线及视线平齐①③④②⑦⑤⑥ABBD
【解析】
(1)根据c=![]() ,故物质的量浓度为18.4mol/L.
,故物质的量浓度为18.4mol/L.
(2)实验室中没有80mL的容量瓶,因此需要选用100mL的容量瓶,稀释过程中,溶质的物质的量不变,因此100×10-3L×3mol/L=V(H2SO4)×18.4mol/L,解得V(H2SO4)=16.3mL,所选用量筒的规格应为25mL,综上所述,本题应选B;
(3)配制步骤有量取,稀释,移液,洗涤,定容,摇匀等操作,一般用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中,边加边用玻璃棒搅拌,冷却后转移到容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中,向容量瓶中加蒸馏水,当加水至液面距离刻度线时,改用胶头滴管滴加,使溶液的凹液面正好跟刻度相平,盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签,贮存.
故将烧杯中的溶液转移到的容量瓶中,向容量瓶中加入蒸馏水,在距离刻度时,改用胶头滴管加蒸馏水至刻度线。故答案应为:玻璃棒引流转移入100mL容量瓶中;至距离刻度线1-2cm处,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线及视线平齐;
(4)由以上实验步骤可知,实验操作正确的顺序为:①③④②⑦⑤⑥.
(5)A、未经冷却趁热将溶液注入容量瓶中,由于热胀冷缩,导致定容体积减小,最终溶液浓度偏高;
B、将量筒中残留的浓硫酸洗涤后,转移入容量瓶中,导致浓硫酸物质的量增加,最终溶液的浓度偏高;
C、定容时仰视液面读数,导致溶液体积偏大,最终溶液浓度偏低;
D、量取浓硫酸时俯视读数,导致浓硫酸物质的量偏小,最终溶液浓度偏低;
综上所述,本题应选AB;
(6)溶液的浓度和密度不会随溶液体积变化,而溶液中溶质的物质的量n=c×V,因此与体积有关,溶液中粒子数目N=n.NA =c×V×NA ,因此粒子数目也与体积有关;
综上所述,本题应选BD。


科目:高中化学 来源: 题型:
【题目】铁和锌的混合物共31.6克,与足量稀硫酸反应,产生标准状况下氢气11.2 升,
问:①产生标准状况下氢气的物质的量是多少?__________
②混合物中锌的物质的量是多少___________?铁的质量是多少?___________
③参与反应的硫酸物质的量是多少?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:
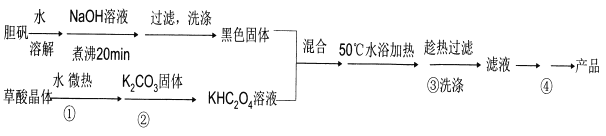
(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同质量的SO2和SO3,它们之间的关系正确的是
A. 所含硫原子的物质的量之比为1:1 B. 所含氧原子的物质的量之比为3:2
C. 氧元素的质量比为6: 5 D. 硫元素的质量比为5:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在80 g密度为d g/cm3的硫酸铁溶液中,含有2.8 g Fe3+离子,则此溶液中SO42-的物质的量浓度为_____________
(2)由N2和CO2组成的混合气体的密度在同温、同压下是氢气密度的16倍,则该混合气体中N2和CO2的体积比为_______________________
(3)标准状况下,1.12LNOx气体质量为2.3g,则x的值为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH﹣+H++![]() →BaSO4↓+H2O
→BaSO4↓+H2O
B. 将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO﹣+CO2↑+H2O
D. 将Cl2通入水中:Cl2+H2O===2H++Cl﹣+ClO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。
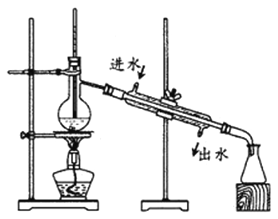
(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com