
����Ŀ������ˮ�Ǻϳ�ϩ���ij��÷�����ʵ���Һϳɻ���ϩ�ķ�Ӧ��ʵ��װ�����£�
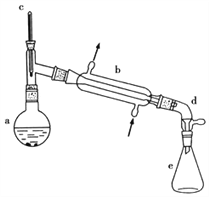

�����õ����й��������£�
��Է������� | �ܶ�/��g��cm-3�� | �е�/�� | �ܽ��� | |
������ | 100 | 0.9618 | 161 | ����ˮ |
����ϩ | 82 | 0.8102 | 83 | ������ˮ |
��1���ϳɷ�Ӧ����a�м���20g��������2СƬ���Ƭ����ȴ��������������1mLŨ���ᣬb��ͨ����ȴˮ��ʼ��������a�������������¶Ȳ�����90�档
��2�������ᴿ��
��Ӧ�ֲ��ﵹ���Һ©���У��ֱ�������5%̼������Һ��ˮϴ�ӣ�����������ˮ�Ȼ��ƿ���������һ��ʱ�����ȥ�Ȼ��ƣ�����ͨ������õ���������ϩ10g��
�ش��������⣺
��1��װ��b������____________
��2���������һ��ʱ��������ǼӴ�Ƭ��Ӧ�ò�ȡ����ȷ������_________������ȷ�𰸱�ţ�
A�����̲��� B����ȴ�� C�����貹�� D����������
��3����ʵ���������ײ����ĸ�����Ľṹ��ʽΪ_______________________
��4���ڱ�ʵ��ķ�������У�����Ӧ�ӷ�Һ©����_________________����Ͽڵ��������¿ڵ�������
��5�������ᴿ�����м�����ˮ�Ȼ��Ƶ�Ŀ����________________________
��6���������ռ���Ʒʱ�� ���Ƶ��¶�Ӧ��____________���ң�ʵ���ƵõĻ���ϩ��Ʒ�����������۲��������ܵ�ԭ����______________������ţ�
a.����ʱ��70�濪ʼ�ռ���Ʒ
b.������ʵ����������
c.�Ʊ���Ʒʱ���������Ʒһ������
���𰸡� ֱ�������ܣ������ܣ� B ![]() �Ͽڵ��� �����ȥˮ�� 83�� C
�Ͽڵ��� �����ȥˮ�� 83�� C
����������1����װ��ͼ��֪װ��b������װ���е�����װ�ã�����Ϊ��ֱ�������ܣ������ܣ���
��2���������һ��ʱ��������Ǽ����Ƭ�����Բ��ӣ��������Ƭ��Ҫ���Ѽ��ȵ�Һ����ȴ���ټ��룬��ѡB��
��3�����ȹ����У����������ɷ�����ȥ��Ӧ���ɻ���ϩ�⣬�����Է���ȡ����Ӧ�����Ӽ䷢����ˮ��Ӧ���ɶ���������![]() ���ʱ�ʵ���������ײ����ĸ�����Ľṹ��ʽΪ
���ʱ�ʵ���������ײ����ĸ�����Ľṹ��ʽΪ![]() ��
��
��4�����ڻ���ϩ���ܶȱ�ˮ���ܶ�С������Ӧ���ϲ㣬��Ӧ�ӷ�Һ©�����Ͽڵ�����
��5�������ᴿ�����м�����ˮ�Ȼ���������������ˮ�Ȼ��������ղ�����������ˮ����������Ŀ�ġ�
��6������֪������ϩ�ķе���83�棬�����������ռ���Ʒʱ�����Ƶ��¶�Ӧ��83��������a�������ʱ��70�濪ʼ�ռ���Ʒ�����Ʒ�п��ܻ����������ʣ�ʵ�ʲ�����������۲�������a������b������ӻ�����ʵ������������ȡ�Ļ���ϩ������ʵ�ʲ�����������۲�������b������c����Ʊ���Ʒʱ���������Ʒһ�������������ĵĻ������������ƵõĻ���ϩ��Ʒ�����������۲�������c��ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ������SO2��SO3������֮��Ĺ�ϵ��ȷ����
A. ������ԭ�ӵ����ʵ���֮��Ϊ1:1 B. ������ԭ�ӵ����ʵ���֮��Ϊ3:2
C. ��Ԫ�ص�������Ϊ6: 5 D. ��Ԫ�ص�������Ϊ5:4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����³�ѹ�£����л������Թ�̬���ڵ���
A. ��Ȳ B. ��ȩ C. һ�ȼ��� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����㻯����A��һ�ֻ�������ԭ�ϣ����Դ�ú��ʯ���еõ���A��B��C��D��E��ת����ϵ������ʾ��
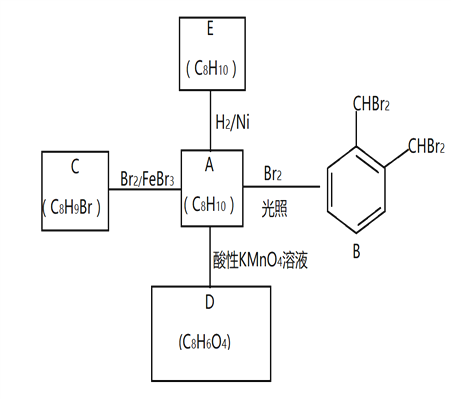
�ش��������⣺
��1��A�Ļ�ѧ������___________
��2��A��B �ķ�Ӧ������______________���ڸ÷�Ӧ�ĸ������У���B��Ϊͬ���칹��ĸ�����Ľṹ��ʽΪ______________________
��3��C�й���������_____________��A������KMnO4��Һ��Ӧ�ɵõ�D��д��D�й���������_______________________________
��4��A��E�Ļ�ѧ����ʽΪ____________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����д��ȷ���ǣ�������
A. H2SO4��Һ��Ba��OH��2��Һ��Ӧ��Ba2++OH��+H++![]() ��BaSO4��+H2O
��BaSO4��+H2O
B. ��NaͶ�뵽CuSO4��Һ�У�2Na+Cu2+===2Na++Cu��
C. ����ʯ���ڴ����У�CaCO3+2CH3COOH===Ca2++2CH3COO��+CO2��+H2O
D. ��Cl2ͨ��ˮ�У�Cl2+H2O===2H++Cl��+ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У���ʹKMnO4������Һ��ɫ����
A. ���� B. ��ϩ C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�������±���ʾ��ѧ��Ӧ�����ݹ�ϵ���ش��������⣺
��ѧ��Ӧ | ƽ�ⳣ�� | �¶� | |
973 K | 1173 K | ||
��Fe(s)��CO2(g)FeO(s)��CO(g) | K1 | 1.50 | 2.15 |
��Fe(s)��H2O(g)FeO(s)��H2(g) | K2 | 2.40 | 1.67 |
��CO(g)��H2O(g)CO2(g)��H2(g) | K3 | �� | �� |
(1)��Ӧ����________(����ȡ����ȡ�)��Ӧ��
(2)��973Kʱ��K3=_________��
(3)Ҫʹ��Ӧ����һ�������½�����ƽ�����淴Ӧ�����ƶ����ɲ�ȡ�Ĵ�ʩ��______(��д��ĸ���)��
A����С��Ӧ�������ݻ� B������Ӧ�������ݻ� C�������¶�
D��ʹ�ú��ʵĴ��� E���跨��Сƽ����ϵ�е�COŨ��
�������л��軯���ڹ�ũҵ������Ӧ�ù㷺��������ұ��ҵ���õ��軯������ˮ�Ĵ����Ե���Ϊ��Ҫ�������ˮ�е��軯�ﳣ��[Fe(CN)6]3-��CN������ʽ����,��ҵ���ж��ַ�ˮ����������
(1)��������
����ͼ��ʾװ�ô�����CN����ˮʱ��������ҺpHΪ9~10������NaCl��һ�������µ�⣬����������ClO����CN������Ϊ�����ʶ���ȥ�����缫Ϊ__________(������� ����������)����������ClO���ĵ缫��ӦΪ__________________________������������ClO����CN-����Ϊ�����ʶ���ȥ�����ӷ���ʽΪ__________________________��
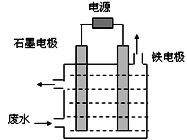
(2)UV(������ߵļ��)��H2O2��������
ʵ����̣�ȡһ���������ˮ������pH������һ�����ʵ�����H2O2������UV����װ���У�
����һ��ʱ���ȡ��������
���������ϡ�
����ǿ������Һ��4[Fe(CN)6]3��+4OH��===4[Fe(CN)6]4��+O2��+2H2O��[Fe(CN)6]4�����ȶ���
��[Fe(CN)6]3��ת��ΪCN�����ױ�H2O2��ȥ��
��HCN���ж������ᣬ�ӷ���
��������ơ�
����д��HCN�ĵ���ʽ________________��
�ں����ˮ�ڲ�ͬpH�µij���Ч����ͼ��ʾ��pHѡ�����ѷ�ΧӦΪ________________��ѡ���ţ�![]() ��7~10��
��7~10��![]() ��10~11��
��10~11��![]() ��11~13��������pH����̫���ԭ��___________________��
��11~13��������pH����̫���ԭ��___________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��CCl4 ������ˮ������ɫҺ�壬�밴����Ҫ�������鷽���������ߣ�
�� ֻ������һ���Լ�������֧�Թֱܷ�ȡ�������� CCl4�� ����ˮ ��Ȼ��ֱ�������� �ĵ��ʵ⣬�����Ϻ�ɫ��Һ�� �� _____�����ػ�ɫ��Һ���� _____��
�� �����κ��Լ������Թ�ȡ����������һ��Һ�壬�ټ�������һ��Һ�壬�²�Һ����______���� ��Һ����_______��
��2��NaCl��Һ�к���������CaCl2��ijѧ���ù����� Na2CO3ʹ Ca2��ת��Ϊ�������� ȥ��ȷ��Na2CO3�� ������ʵ�� ���� �� �� _____��
��3�� ��������������Ʊ������� _____�� ������Ӧ�Ļ�ѧ����ʽΪ_______________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com