
����Ŀ�������(��Ҫ�ɷ�Al2O3��2SiO2��2H2O��������Fe2O3��CaO��MgO������)���������ĺ���������������ʯNa3AlF6�Ĺ����������£�
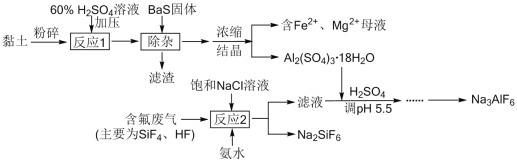
��ش��������⣺
(1) ����ʯ�ڵ��Al2O3�����е�������______���趨�ڸ���ʯī______(����������������)����
(2) ����98%�����������Ӧ1���Ŀ���ԭ����______��
A�����������ӷ�Ӧ����ɽ������½�
B����Ӧ����̫��̫���ң�����˲���Σ��
C�������϶����Է�Һ��Ҳ�����ԭ�ϳɱ�
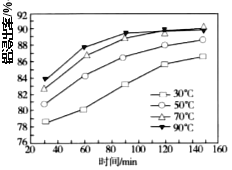
(3) ���������������䣬��Ӧ1�����������ڲ�ͬ�¶�����ʱ��仯��ͼ��ʾ������Ӧ1��������¶���ʱ��ֱ���______����______min��
(4) ��������������������������к���BaSO4��CaSO4��S�������д������S�����ӷ���ʽ______��
(5) ���������![]() ��Һ
��Һ![]() ��Һ
��Һ![]() �����Ʊ�Al2(SO4)3��18H2O���÷�����ԭ�������ʱ�ԭ������______ (����������������)��
�����Ʊ�Al2(SO4)3��18H2O���÷�����ԭ�������ʱ�ԭ������______ (����������������)��
(6) ����Ӧ2����������Һ���к���������ҪΪ______ (д��ѧʽ)��
(7) ��֪Ka(HF)= 6.4��10-4��Al3++ 6F-![]() AlF
AlF![]() ��K=1.0��1019����ʹƽ��ʱc(AlF
��K=1.0��1019����ʹƽ��ʱc(AlF![]() )/c(Al3+)��10���ҵ��ڲ�ά����ҺpH=5.5��������HFƽ��Ũ��Ӧ������______mol/L(����2λ��Ч���֣�100.5�� 3.2)��
)/c(Al3+)��10���ҵ��ڲ�ά����ҺpH=5.5��������HFƽ��Ũ��Ӧ������______mol/L(����2λ��Ч���֣�100.5�� 3.2)��
���𰸡����ۼ� �� AC 70 90 BaS+2Fe3++SO![]() =BaSO4+2Fe2++S �� NH4F 5.0��10-6
=BaSO4+2Fe2++S �� NH4F 5.0��10-6
��������
����м������ᣬAl2O3��Fe2O3��CaO��MgO�����ᷴӦ����Al2(SO4)3��Fe2(SO4)3��CaSO4��MgSO4��SiO2����Ӧ������BaS��Fe3+��ԭΪFe2+��ͬʱ�������ᱵ���������ʣ����˳�ȥ����BaSO4��CaSO4��S��SiO2���������Һ����Ҫ��Al2(SO4)3��FeSO4��MgSO4����Ũ���ᾧ�õ�Al2(SO4)3��18H2O����������SiF4��HF�뱥���Ȼ�����Һ�Ͱ�ˮ��Ӧ����Ҫ����NH4F��Na2SiF6����ҺNH4F�м���Al2(SO4)3��18H2O������pHֵ����ͨ��ת���õ�����ʯNa3AlF6��
(1) ���Al2O3������Al2O3�۵�ߣ�Ϊ��Լ��Դ���������ʯ�ܽ���Al2O3���۵㣬�Ա�Al2O3���ۻ����⣬�������������ۼ������ʱ������O2-ʧ���ӷ���������Ӧ����O2����������ʯī��ü������ɵ�O2��Ӧ�����ģ������趨�ڸ���ʯī������
(2) 98%����Ũ��̫�ߣ�ˮ���٣�ʹ�����ӷ�Ӧ����������ɽ������½���ͬʱ������������˽϶����Է�Һ��Ҳ�����ԭ�ϳɱ������Դ�ѡAC��
(3) ����ͼ֪��ʱ��Խ��������Խ�ߣ��¶�Խ�ߣ�������Խ�ߣ�������90min�����ʱ仯����70���90������ʱ仯������ʱ��������¶ȹ��ߵ��³ɱ��ϴ���������¶���70�棬ʱ����90min��
(4) ���������������BaS��Fe3+��ԭΪFe2+��ͬʱ�������ᱵ���������ʣ����ӷ���ʽΪBaS+2Fe3++SO![]() =BaSO4+2Fe2++S��
=BaSO4+2Fe2++S��
(5) �÷����У��������������ƣ�ԭ�������ʸ��ͣ�
(6) ��������SiF4��HF�뱥���Ȼ�����Һ�Ͱ�ˮ��Ӧ����Ҫ����NH4F��Na2SiF6������Һ���к���������ҪΪNH4F��
(7) ����Al3++ 6F-![]() AlF
AlF![]() ��K=1.0��1019����
��K=1.0��1019����![]() ����֪c(AlF
����֪c(AlF![]() )/c(Al3+)��10����c(F-)��1.0��10-3����pH=5.5����c(H+)=10-5.5mol/L =3.2��10-5mol/L������Ka(HF)= 6.4��10-4��
)/c(Al3+)��10����c(F-)��1.0��10-3����pH=5.5����c(H+)=10-5.5mol/L =3.2��10-5mol/L������Ka(HF)= 6.4��10-4��![]() ������c(F-)��1.0��10-3mol/L��c(H+)=3.2��10-5mol/L����
������c(F-)��1.0��10-3mol/L��c(H+)=3.2��10-5mol/L����![]() mol/L��
mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С������ʵ���ʾ��ͼ��ͼ��ʾ��ͼ�С�������ʾ�������� M��һ�ִ�������������壬YΪ��һ�����壬E���к���ɫ���������ʵ����������ֻ��������������ѡȡ��Na2CO3��Na2O2��NaCl��Na2O��CaCl2��(NH4)2CO3����ʯ�ҵȹ��弰����ˮ���ݴ�ʵ�飬���������գ�

(1)A������װ�õ���Ҫ������ҩƷ��______________________��
(2)B����ѡ�ĸ������________����������______________________________��
(3)C�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ��________________________________��
(4)��ȡY�����Dװ�����õ���Ҫ������__________________________��
��ȡY����Ļ�ѧ����ʽ��________________________��
(5)F�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ijѧУʵ���Ҵӻ�ѧ�Լ��̵���ص�Ũ�����Լ���ǩ�ϵIJ������ݡ�

�����ø�Ũ�������Ƴ�1mol/L��ϡ���ᣬ��ʵ���ҽ���Ҫ����ϡ����220mL���Իش��������⣺
��1������Ͳ��ȡ��Ũ����____________mL��
��2������ʱ������ʹ�õ���������Ͳ���ձ����������⣬��ȱ�ٵ�������____��
��3��������Һ�Ĺ����У�������������ȷ�����в�����ʹ������ҺŨ��ƫ�ߵ���__________��
A������Ͳ��ȡŨ����ʱ����
B��ϡ��Ũ����ʱ��δ��ȴ�����¼�ת�Ƶ�����ƿ��
C����ȡŨH2SO4�����Ͳ����ϴ�ӣ�����ϴ��Һת�Ƶ�����ƿ��
D������ҡ�Ⱥ���Һ����ڿ̶��ߣ����ý�ͷ�ιܼ�����ˮ����Һ����ʹ���̶�������
E������ƿ������
F������ʱ����������ƿ�̶���
��4��ijͬѧ�ù���Na2CO3����500 mlL 0.1molL-1��Һ�Ĺ�����ͼ��ʾ��

����Ϊ��ͬѧ�Ĵ�������__________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и��������У�����֮��ͨ��һ����Ӧ����ʵ����ͼ��ʾת����������Ӧ������ȷ���ǣ�������
��� | X | Y | Z | ��ͷ���������ֵķ�Ӧ���� |
�� | SiO2 | Na2SiO3 | H2SiO3 | ����Na2CO3���� |
�� | Na | Na2O2 | NaCl | �ڼ�H2O |
�� | NO | NO2 | HNO3 | ����C���� |
�� | Al2O3 | NaAlO2 | Al(OH)3 | ����NaOH |

A.�٢�B.�٢�C.�ۢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ�����ã����������һ����ɫ���壬Ϊ�˽�ͭ�ڿ����еĸ�ʴ�����ij��ѧ��ȤС���ռ�����ͭ���������ɫ�������̽��������������Ϻ������ɫ���ʿ�����ͭ��̼���Ρ�
��С��ͬѧ������ͼװ�ý���ʵ��(���ּг�������)��
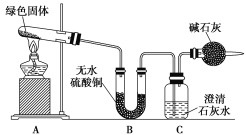
�ٶ��Թ��ڵ���ɫ������м��ȣ�����ȫ�ֽ⣬�۲쵽Aװ������ɫ������ɺ�ɫ��Bװ������ˮ����ͭ�����ɫ��Cװ���г���ʯ��ˮ����ǡ�
��ȡ�������Ⱥ����ɵĺ�ɫ�������Թ��У�����ϡ���ᣬ�۲쵽��ɫ�������ܽ⣬��Һ�����ɫ��
��ȡ����������ɫ��Һ���Թ��У�����һ���ྻ����˿���۲쵽��˿�����к�ɫ����������
��ش��������⣺
(1)��ɫ�����к��е�Ԫ����________________________________________________��
(2)���Ⱥ��Թ���ʣ��ĺ�ɫ������_________________________________________________��
(3)�������ɫ������һ�ִ�������仯ѧʽ������______________�����ȷֽ�Ļ�ѧ����ʽΪ_______________________________________________________________________________________��
(4)����ʵ�鲽����еķ�Ӧ�����ӷ���ʽΪ________________________________________��
(5)ʵ��װ�����ĸ���ܵ�������___________________________________________________��
(6)�����B��C��װ�öԵ����ܷ�ﵽʵ��Ŀ��______(������������������)��Ϊʲô��_____________________________________________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����CaCO3(s)��CaO(s) + CO2(g) ��H = + 177.7 kJ��mol-1
��C(s) + H2O(g)��CO(g) + H2(g) ��H = -131.3 kJ��mol-1
��1/2H2SO4(l) + NaOH(l)��1/2Na2SO4(l) + H2O(l) ��H = -57.3 kJ��mol-1
��C(s) + O2(g)��CO2(g) ��H = -393.5 kJ��mol-1
��CO(g) + 1/2O2(g)��CO2(g) ��H = -283 kJ��mol-1
��a�������Ȼ�ѧ����ʽ�б�ʾ����ȷ����__������ţ���
��b������������Ϣ��д��Cת��ΪCO���Ȼ�ѧ����ʽ__________��
��2����֪�Ȼ�ѧ����ʽ��H2(g)+1/2O2(g)��H2O(g)��H = -241.8 kJ��mol-1���÷�Ӧ�Ļ��Ϊ167.2 kJ��mol-1�������淴Ӧ�Ļ��Ϊ__kJ��mol-1��
��3����CH4����ԭNOx�������������������Ⱦ�����磺
CH4(g)+ 4NO2(g)��4NO(g)+ CO2(g)+ 2H2O(g) ��H =��574 kJ��mol-1
CH4(g)+ 4NO(g)��2N2(g)+ CO2(g)+ 2H2O(g) ��H =��1160 kJ��mol-1
���ñ�״����4.48 L CH4��ԭNO2����N2����Ӧ��ת�Ƶĵ�������Ϊ__���ð����ӵ�����NA��ʾ�����ų�������Ϊ__kJ��
��4�������й��к��ȵ�˵����ȷ������________��
A����ʾ�к��ȵ��Ȼ�ѧ����ʽ��H��(l)��OH��(l)��H2O(l) ��H�� -57.3 kJ��mol��1
B��ȷ�����к��ȵ�ʵ������У��������¼�¶�4��
C���к��ȵ�ʵ������У����β����������������ͭ���棬���������к�����ֵƫС
D����֪2NaOH(aq)��H2SO4(aq)��Na2SO4(aq)��2H2O(l) ��H��-114.6 kJ��mol��1����÷�Ӧ���к���Ϊ57.3 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ij�ܱ������м��� 0.3 mol A��0.1 mol C ��һ������ B �������壬ͼ 1 ��ʾ������Ũ����ʱ��ı仯��ͼ 2 ��ʾ������ʱ��ı仯��t2��t3��t4��t5 ʱ�̸��ı�һ���������Ҹı����������ͬ����t4ʱ�� �ı��������ѹǿ��������˵���������

A.�� t1=15 s����ǰ 15 s ��ƽ����Ӧ���� v(C)=0.004 mol��L-1��s-1
B.�÷�Ӧ�Ļ�ѧ����ʽΪ 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2��t3��t5 ʱ�̸ı�������ֱ��������¶ȡ��������������Ӧ��Ũ��
D.�� t1=15 s���� B ����ʼ���ʵ���Ϊ 0.04 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D����Ԫ�ض��Ƕ�����Ԫ�أ�AԪ�ص����Ӿ��л�ɫ����ɫ��Ӧ��BԪ�ص����ӽṹ��Ne ������ͬ�ĵ��Ӳ��Ų���5.8 g B����������ǡ������100 mL2 mol��L-1������ȫ��Ӧ��Bԭ�Ӻ�������������������ȡ�H2��C������ȼ�ղ�����ɫ���档DԪ��ԭ�ӵĵ��Ӳ�ṹ�У������������Ǵ�����������3��������������������������⣺
(1)CԪ��λ�ڵ�______���ڵ�_____�壬�������������Ļ�ѧʽΪ____��
(2)AԪ����_____��BԪ����_____��DԪ����_____��(��Ԫ�ط���)
(3)A��D�γ��ȶ�������Ļ�ѧʽ��______���û������д��ڵĻ�ѧ������Ϊ___���жϸû������ڿ������Ƿ���ʵļ�����______��
(4)CԪ�صĵ����ж�������A������������Ӧ��ˮ�������Һ���գ������ӷ���ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na��Al��Fe��Cu����ѧ��ѧ����Ҫ�Ľ���Ԫ�ء����ǵĵ��ʼ��仯����֮���кܶ�ת����ϵ���±��������ʲ��ܰ���ͼ����������ʾһ����ɣ���ϵ�ת������ �� ��
ѡ�� | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al��OH��3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com