
【题目】A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne 具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL2 mol·L-1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件完成下列问题:
(1)C元素位于第______周期第_____族,它的最高价氧化物的化学式为____。
(2)A元素是_____,B元素是_____,D元素是_____。(填元素符号)
(3)A与D形成稳定化合物的化学式是______,该化合物中存在的化学键类型为___,判断该化合物在空气中是否变质的简单方法是______。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______。
【答案】三 ⅦA Cl2O7 Na Mg O Na2O2 离子键和(非极性)共价键 看表面颜色是否变白 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应,则A为Na元素;5.8 g B的氢氧化物恰好能与100 mL2 mol/L盐酸完全反应,n(H+)=n(OH-),设B的化合价为x,摩尔质量为y,则![]() ×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6符合,即D为O元素,然后利用元素及其单质、化合物的性质来解答。
×x=0.2,显然x=2,y=24符合,B原子核中质子数和中子数相等,则B的质子数为12,即B为Mg元素;H2在C单质中燃烧产生苍白色火焰,则C为Cl元素;D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍,则次外层为2,最外层为6符合,即D为O元素,然后利用元素及其单质、化合物的性质来解答。
根据上述分析可知A是Na,B是Mg,C是Cl,D是O元素。
(1)C是Cl元素,Cl原子核外电子排布为2、8、7,根据原子核外电子排布与元素位置的关系可知:Cl位于元素周期表第三周期第ⅦA族,Cl最外层有7个电子,最高化合价为+7价,其最高价氧化物为Cl2O7;
(2)根据以上分析可知A是Na元素,B是Mg元素,D是O元素;
(3)A、D两种元素形成的稳定氧化物是Na2O2,该物质属于离子晶体,含有离子键和非极性共价键。过氧化钠为淡黄色,Na2O2容易与空气中的CO2、H2O发生反应,若变质,最终会变为白色的Na2CO3,所以判断该化合物在空气中是否变质的简单方法是看表面颜色是否变白;
(4)C是Cl元素,其单质Cl2是有毒气体,可根据Cl2能够与NaOH溶液反应的性质除去,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,在三个容积均为1L的恒容密闭容器中仅发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
2SO3(g) ΔH<0,达到平衡时,下列说法不正确的是
容器 编号 | 容器类型 | 起始物质的量 / mol | 平衡时SO3的物质的量 / mol | ||
SO2 | O2 | SO3 | |||
I | 恒温恒容 | 2 | 1 | 0 | 1.8 |
II | 恒温恒压 | 2 | 1 | 0 | a |
III | 绝热恒容 | 0 | 0 | 2 | b |
A. 容器I中SO2的转化率小于容器II中SO2的转化率
B. 容器II的平衡常数大于容器III中的平衡常数
C. 平衡时SO3的物质的量:a>1.8、b>1.8
D. 若起始时向容器I中充入0.10 mol SO2(g)、0.20mol O2(g)和2.0 mol SO3(g),则此时v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由黏土(主要成分Al2O3·2SiO2·2H2O,含少量Fe2O3、CaO、MgO等杂质)与磷肥生产的含氟废气生产冰晶石Na3AlF6的工艺流程如下:
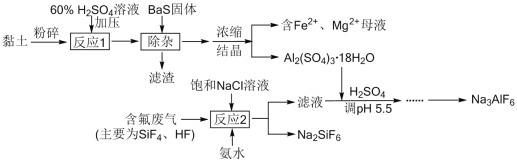
请回答下列问题:
(1) 冰晶石在电解Al2O3制铝中的作用是______,需定期更换石墨______(填“阳”或“阴”)极。
(2) 不用98%硫酸进行“反应1”的可能原因是______。
A.不易发生离子反应,造成浸出率下降
B.反应速率太快太剧烈,造成了操作危险
C.产生较多酸性废液,也提高了原料成本
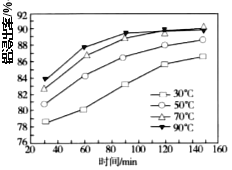
(3) 保持其他条件不变,反应1的铝浸出率在不同温度下随时间变化如图所示。“反应1”的最佳温度与时间分别是______℃、______min。
(4) “除杂”步骤产生的“滤渣”中含有BaSO4、CaSO4、S等难溶物,写出产生S的离子方程式______。
(5) 若按“黏土![]() 滤液
滤液![]() 溶液
溶液![]() ”来制备Al2(SO4)3·18H2O,该方案的原料利用率比原方案更______ (填“高”或“低”)。
”来制备Al2(SO4)3·18H2O,该方案的原料利用率比原方案更______ (填“高”或“低”)。
(6) “反应2”所得“滤液”中含氟物质主要为______ (写化学式)。
(7) 已知Ka(HF)= 6.4×10-4,Al3++ 6F-![]() AlF
AlF![]() 的K=1.0×1019,欲使平衡时c(AlF
的K=1.0×1019,欲使平衡时c(AlF![]() )/c(Al3+)≥10,且调节并维持滤液pH=5.5,则其中HF平衡浓度应不低于______mol/L(保留2位有效数字,100.5≈ 3.2)。
)/c(Al3+)≥10,且调节并维持滤液pH=5.5,则其中HF平衡浓度应不低于______mol/L(保留2位有效数字,100.5≈ 3.2)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应2A(g)![]() B(g) ΔH>0在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的
B(g) ΔH>0在密闭容器中达到平衡,平衡后c(A)/c(B)=a,若改变某一条件,足够时间后反应再次达到平衡状态,此时c(A)/c(B)=b,下列叙述正确的
A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a<b
B.在该温度恒压条件下再充入少量B气体,则a=b
C.若其他条件不变,升高温度,则a<b
D.若保持温度、压强不变,充入惰性气体,则a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂。工业上由废铁生产FeSO47H2O的一种流程如图:
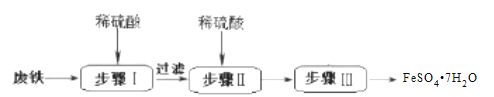
(1)步骤Ⅰ的操作前往往需要热碱溶液冲洗,其目的是_____。
(2)步骤Ⅰ加入稀硫酸的量不能过量的原因是_____。步骤Ⅱ加入稀硫酸的目的是_____。
(3)步骤Ⅲ从硫酸亚铁溶液中获得碱酸亚铁晶体(FeSO47H2O) 的实验操作为_____、_____、_____。烘干操作需在低温条件下进行,原因是_____。
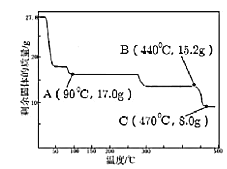
(4)取27.8g FeSO47H2O加热至不同温度,剩余固体的质量变化如上图所示。分析数据,90℃残留物的化学式是_____。440℃~470℃时固体物质发生反应的化学方程式是_____,做出这一判断的依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
![]()
(1)A的化学式是__________,B的化学式是________,C的化学式是__________。
(2)加入过量A的目的是__________________。
(3)加入过量B的目的是____________________。
(4)加热煮沸的目的是________________________。
(5)操作Ⅰ的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质两两混合,不能用Ca2++![]() ═CaCO3↓表示的是( )
═CaCO3↓表示的是( )
A.Ca(OH)2与Na2CO3B.CaCl2与K2CO3
C.CaCl2与Na2CO3D.Ca(OH)2与(NH4)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:反应①O3![]() O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3
O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3![]() 2O2ΔH<0平衡常数为K2;总反应:2O3
2O2ΔH<0平衡常数为K2;总反应:2O3![]() 3O2ΔH<0衡常数为K。下列叙述正确的是( )
3O2ΔH<0衡常数为K。下列叙述正确的是( )
A.升高温度,K增大B.K=K1+K2
C.适当升温,可提高消毒效率D.压强增大,K2减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法不正确的是

A.31d和33d属于不同种核素
B.a和b形成的化合物不可能含共价键
C.a、d、e三种元素均可形成至少两种性质不同的单质
D.工业上常用电解法制备单质b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com