
【题目】硫酸亚铁晶体(FeSO47H2O)在医药上作补血剂。工业上由废铁生产FeSO47H2O的一种流程如图:
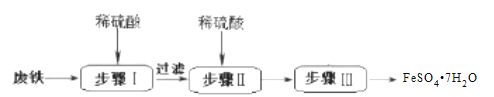
(1)步骤Ⅰ的操作前往往需要热碱溶液冲洗,其目的是_____。
(2)步骤Ⅰ加入稀硫酸的量不能过量的原因是_____。步骤Ⅱ加入稀硫酸的目的是_____。
(3)步骤Ⅲ从硫酸亚铁溶液中获得碱酸亚铁晶体(FeSO47H2O) 的实验操作为_____、_____、_____。烘干操作需在低温条件下进行,原因是_____。
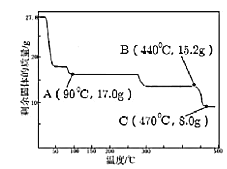
(4)取27.8g FeSO47H2O加热至不同温度,剩余固体的质量变化如上图所示。分析数据,90℃残留物的化学式是_____。440℃~470℃时固体物质发生反应的化学方程式是_____,做出这一判断的依据是_____。
【答案】除去废铁表面的油污 确保生成物全部都是硫酸亚铁 防止亚铁离子水解 蒸发浓缩 冷却结晶 过滤洗涤 低温条件下蒸发浓缩,降低烘干的温度,防止FeSO47H2O分解失去部分结晶水 FeSO4H2O 2FeSO4![]() Fe2O3+SO2↑+SO3↑ 剩余固体是8g,为Fe2O3,根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则有生成SO2,由质量守恒定律得出化学反应
Fe2O3+SO2↑+SO3↑ 剩余固体是8g,为Fe2O3,根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则有生成SO2,由质量守恒定律得出化学反应
【解析】
废铁含有碳以及其它金属杂质,加入热碱溶液冲洗,可除去表面的油污,加入稀硫酸,使铁全部转化为硫酸亚铁,并过滤,在滤液中加入稀硫酸可防止亚铁离子水解,经蒸发浓缩、冷却结晶、过滤洗涤得到FeSO47H2O,27.8g FeSO47H2O的物质的量为![]() 0.1mol,其中m(FeSO4)=15.2g,m(H2O)=12.6g,分解可生成Fe2O3,质量为0.05mol×160g/mol=8.0g,则由图象可知,A为FeSO4的部分结晶水合物,B为FeSO4,C为Fe2O3,以此解答该题。
0.1mol,其中m(FeSO4)=15.2g,m(H2O)=12.6g,分解可生成Fe2O3,质量为0.05mol×160g/mol=8.0g,则由图象可知,A为FeSO4的部分结晶水合物,B为FeSO4,C为Fe2O3,以此解答该题。
(1)步骤Ⅰ的操作前往往需要热碱溶液冲洗,其目的是除去废铁表面的油污,因油脂在碱性条件下水解,烧碱溶液有去油腻的能力,故答案为:除去废铁表面的油污;
(2)步骤Ⅰ加入稀硫酸的量不能过量的原因是确保生成物全部都是硫酸亚铁,避免硫酸过量其它金属杂质与硫酸反应,步骤Ⅱ加入稀硫酸的目的是防止亚铁离子水解,故答案为:确保生成物全部都是硫酸亚铁;防止亚铁离子水解;
(3)步骤Ⅲ从硫酸亚铁溶液中获得碱酸亚铁晶体(FeSO47H2O)的实验操作为蒸发浓缩、冷却结晶、过滤洗涤,烘干操作需在低温条件下进行,原因是低温条件下蒸发浓缩,降低烘干的温度,防止FeSO47H2O分解失去部分结晶水,故答案为:蒸发浓缩、冷却结晶、过滤洗涤;低温条件下蒸发浓缩,降低烘干的温度,防止FeSO47H2O分解失去部分结晶水;
(4)由以上分析可知90℃残留物质量为17.0g,其中m(FeSO4)=15.2g,n(FeSO4)=0.1mol,m(H2O)=1.8g则n(H2O)![]() 0.1mol,则化学式为FeSO4H2O,0.1molFeSO4可生成0.05molFe2O3,质量为0.05mol×160g/mol=8.0g,440℃~470℃时固体物质为Fe2O3,发生反应的化学方程式是2FeSO4
0.1mol,则化学式为FeSO4H2O,0.1molFeSO4可生成0.05molFe2O3,质量为0.05mol×160g/mol=8.0g,440℃~470℃时固体物质为Fe2O3,发生反应的化学方程式是2FeSO4![]() Fe2O3+SO2↑+SO3↑,做出这一判断的依据是剩余固体是8g,为Fe2O3,根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则有生成SO2,由质量守恒定律得出化学反应,故答案为:FeSO4H2O;2FeSO4
Fe2O3+SO2↑+SO3↑,做出这一判断的依据是剩余固体是8g,为Fe2O3,根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则有生成SO2,由质量守恒定律得出化学反应,故答案为:FeSO4H2O;2FeSO4![]() Fe2O3+SO2↑+SO3↑;剩余固体是8g,为Fe2O3,根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则有生成SO2,由质量守恒定律得出化学反应。
Fe2O3+SO2↑+SO3↑;剩余固体是8g,为Fe2O3,根据氧化还原反应规律推断铁元素化合价升高,必有元素化合价降低,则有生成SO2,由质量守恒定律得出化学反应。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组对铝热反应实验展开研究,对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知Al、Al2O3、Fe、Fe2O3的熔、沸点数据如表。
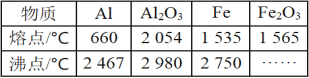
(1)某同学推测,铝热反应所得到的熔融物可能是铁铝合金。理由是___。
(2)某同学提出“反应放出大量的热,并发出耀眼的光芒……”,有可能只是发生了铝单质的燃烧放大量热。试利用化学性质设计实验验证铝热反应的发生:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。
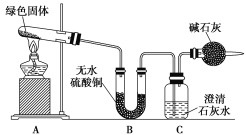
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是________________________________________________。
(2)加热后试管中剩余的黑色物质是_________________________________________________。
(3)假设该绿色物质是一种纯净物,则其化学式可能是______________,加热分解的化学方程式为_______________________________________________________________________________________。
(4)上述实验步骤③中的反应的离子方程式为________________________________________。
(5)实验装置最后的干燥管的作用是___________________________________________________。
(6)如果将B、C两装置对调,能否达到实验目的______(填“能”或“不能”),为什么?_____________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体,图 1 表示各物质浓度随时间的变化,图 2 表示速率随时间的变化,t2、t3、t4、t5 时刻各改变一种条件,且改变的条件均不同。若t4时刻 改变的条件是压强,则下列说法错误的是

A.若 t1=15 s,则前 15 s 的平均反应速率 v(C)=0.004 mol·L-1·s-1
B.该反应的化学方程式为 3A(g)![]() B(g)+2C(g)
B(g)+2C(g)
C.t2、t3、t5 时刻改变的条件分别是升高温度、加入催化剂、增大反应物浓度
D.若 t1=15 s,则 B 的起始物质的量为 0.04 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间有如下反应关系:
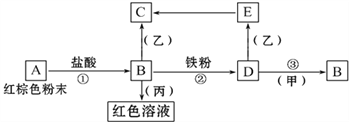
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素都是短周期元素,A元素的离子具有黄色的焰色反应。B元素的离子结构和Ne 具有相同的电子层排布;5.8 g B的氢氧化物恰好能与100 mL2 mol·L-1盐酸完全反应;B原子核中质子数和中子数相等。H2在C单质中燃烧产生苍白色火焰。D元素原子的电子层结构中,最外层电子数是次外层电子数的3倍。根据上述条件完成下列问题:
(1)C元素位于第______周期第_____族,它的最高价氧化物的化学式为____。
(2)A元素是_____,B元素是_____,D元素是_____。(填元素符号)
(3)A与D形成稳定化合物的化学式是______,该化合物中存在的化学键类型为___,判断该化合物在空气中是否变质的简单方法是______。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对牙膏的探究要用到许多化学知识。
(1)下表列出了三种牙膏中的摩擦剂,请在表中填写三种摩擦剂所属的物质类别:____、____、_____。

(2)根据你的推测,牙膏摩擦剂在水中的溶解性是__(填“易溶”或“难溶”)。
(3)Y牙膏中的摩擦剂——碳酸钙可以用石灰石来制备,某学生设计了一种实验室制备碳酸钙的实验方案,其流程如图所示:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请写出上述方案中有关反应的化学方程式:
①__;
②__;
③__。
(4)请你仍用石灰石作原料(其他试剂自选),设计实验室制备碳酸钙的另一种实验方案,依照(3)所示的方式,将你的实验方案用流程图表示出来:
![]() →_。
→_。
(5)检验牙膏中是否含有碳酸钙的实验方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com