
����Ŀ��ij�о���ѧϰС������ȷ�Ӧʵ��չ���о����ԡ����ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â����ֽ©�����²����մ���������������ɳ�С�����֪Al��Al2O3��Fe��Fe2O3���ۡ��е����������
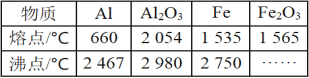
��1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ�������������������Ͻ�������___��
��2��ijͬѧ�������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â���������п���ֻ�Ƿ����������ʵ�ȼ�շŴ����ȡ������û�ѧ�������ʵ����֤���ȷ�Ӧ�ķ�����___��
���𰸡��̷̹�Ӧ����֡������۵���������۵� ȡһ������Ʒ���Թܣ���������ŨNaOH�������Ӧ��ֱ����������������ã���������������Һ���ڹ����м�����ϡ�����ܽ���ټ������軯���Լ�����������ɫ������֤�����ȷ�Ӧ�ѷ�����
��������
(1)���ݱ������ݿ�֪�����۵���������۵㣬�ҹ̷̹�Ӧ����֣��������ȷ�Ӧ���õ�������������������Ͻ�
(2)Ҫ֤�����ȷ�Ӧ�ѷ���ֻ��Ҫ˵����Ӧ���������ɼ��ɣ�����ʵ�鷽��Ϊȡһ������Ʒ���Թܣ���������ŨNaOH�������Ӧ��ֱ����������������ã���������������Һ���ڹ����м�����ϡ�����ܽ���ټ������軯���Լ�����������ɫ����,��֤�����ȷ�Ӧ�ѷ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O5��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��һ���¶��£���2L�����ܱ������з�����Ӧ��2N2O5(g)![]() 4NO2(g)��O2(g) ��H��0����Ӧ��Ͳ�������������ʵ����淴Ӧʱ��仯��������ͼ������˵������ȷ���ǣ� ��
4NO2(g)��O2(g) ��H��0����Ӧ��Ͳ�������������ʵ����淴Ӧʱ��仯��������ͼ������˵������ȷ���ǣ� ��
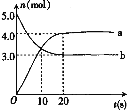
A.0��20s�ڣ�ƽ����Ӧ����v(N2O5)��0.05 mol��L��1��s��1
B.�����¶ȣ���ʹ���淴Ӧ���ʾ�����
C.�ﵽƽ��ʱ����������ѹǿ���ֲ���
D.10 sʱ�������淴Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L 0.1 mol/L�Ĵ�����Һ������ˮϡ�͵�10 L������������ȷ������������
A. c��CH3COOH����Ϊԭ����1/10
B. c��H������Ϊԭ����![]()
C. c��CH3COO����/c��CH3COOH���ı�ֵ����
D. ��Һ�ĵ�������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ2L�ĸ����ܱ������м���1molCO2��3molH2��������Ӧ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)���������������������£��¶ȶԷ�Ӧ��Ӱ����ͼ��ʾ(ע��T1��T2������300��)������˵����ȷ���ǣ� ��
CH3OH(g)+H2O(g)���������������������£��¶ȶԷ�Ӧ��Ӱ����ͼ��ʾ(ע��T1��T2������300��)������˵����ȷ���ǣ� ��
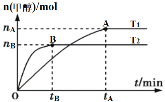
A.�÷�Ӧ��T1ʱ��ƽ�ⳣ������T2ʱ��С
B.����A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ![]() ��С
��С
C.T2ʱ����Ӧ�ﵽƽ��ʱ���ɼ״��ķ�Ӧ����v(CH3OH)=![]() mol��L-1��min-1
mol��L-1��min-1
D.T1ʱ������Ӧ�ﵽƽ���CO2��ת����Ϊx���������ڵ�ѹǿ����ʼѹǿ֮��Ϊ(2-x)��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��߷��ӻ��������һ�ֳ��õĹ����߷��Ӳ��ϣ���ṹ��ʽΪ��![]() ����A��XΪԭ�ϣ����������̿��Ժϳɼף������Լ�I����һ��������Ȳ����ˮ��Ӧ�Ƶã��Լ�X������ͼ��ʾ���ķ�ֵΪ106��
����A��XΪԭ�ϣ����������̿��Ժϳɼף������Լ�I����һ��������Ȳ����ˮ��Ӧ�Ƶã��Լ�X������ͼ��ʾ���ķ�ֵΪ106��
��֪��a.��CH2OH+��CH2OH![]() ��CH2OCH2��+H2O
��CH2OCH2��+H2O
b.![]() +
+![]() +H2O
+H2O
c.�ǻ�ֱ������̼̼˫����̼����һ�ֲ��ȶ��Ľṹ���������������ŴӶ�ת��Ϊ�ȶ��ṹ��![]()
��ش��������⣺
��1����֪A��������Ԫ�ص���������Ϊ19.88%��̼Ԫ�ص���������Ϊ29.81%������Ϊ��Ԫ�غ���Ԫ�أ���A�ĺ˴Ź������������������շ壬�����֮��Ϊ2��2��1����A�Ľṹ��ʽΪ___��
��2������˵������ȷ����___��
A.�л���A�ܷ���ˮ�ⷴӦ����ˮ���������������������Ŀ�����
B.�л���X������������Na���ʷ����û���Ӧ��ͬ���칹����
C.�л���G�ķ���ʽΪC13H14O3���ܷ���ȡ�����ӳɡ���������ԭ���Ӿ۷�Ӧ
D.�л���D���������4ԭ�ӹ��ߣ�������ԭ�Ӿ����ܹ���
��3��д��B��C�Ļ�ѧ����ʽ��___��
��4��H��E��ͬ���칹�壬д����������������H�Ľṹ��ʽ___��
��1molH������������Cu(OH)2��ַ�Ӧ����2molCu2O��
��H�ĺ˴Ź��������Ϲ����ĸ����շ塣
��5����������ϩ��(PVAc)��һ�����߷��Ӳ��ϣ��������ȶ�������ճ��ǿ�ȸߣ���һ�ֻ����Ľ����������AΪԭ���Ʊ���������ϩ��������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪTʱ���������ݻ���Ϊ1L�ĺ����ܱ������н�������Ӧ��2SO2(g)��O2(g)![]() 2SO3(g) ��H��0���ﵽƽ��ʱ������˵������ȷ����
2SO3(g) ��H��0���ﵽƽ��ʱ������˵������ȷ����
���� ��� | �������� | ��ʼ���ʵ��� / mol | ƽ��ʱSO3�����ʵ��� / mol | ||
SO2 | O2 | SO3 | |||
I | ���º��� | 2 | 1 | 0 | 1.8 |
II | ���º�ѹ | 2 | 1 | 0 | a |
III | ���Ⱥ��� | 0 | 0 | 2 | b |
A. ����I��SO2��ת����С������II��SO2��ת����
B. ����II��ƽ�ⳣ����������III�е�ƽ�ⳣ��
C. ƽ��ʱSO3�����ʵ�����a��1.8��b��1.8
D. ����ʼʱ������I�г���0.10 mol SO2(g)��0.20mol O2(g)��2.0 mol SO3(g)�����ʱv����v��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ѧ�һ���˼��������о������N4���ӡ�N4���ӽṹ��ͼ��ʾ����֪����1 mol N��N����167 kJ�������γ�1 mol ![]() �ų�942 kJ��������N2(g)��3H2(g)
�ų�942 kJ��������N2(g)��3H2(g)![]() 2NH3(g) ��H1����92 kJ/mol��N4(g)��6H2(g)
2NH3(g) ��H1����92 kJ/mol��N4(g)��6H2(g)![]() 4NH3(g) ��H2(kJ/mol)����������Ϣ�����ݣ�����˵����ȷ����(����)
4NH3(g) ��H2(kJ/mol)����������Ϣ�����ݣ�����˵����ȷ����(����)

A.��H2��0B.N2���ӱ�N4�����ȶ�
C.��H2��2��H1D.��H2�뷽��ʽϵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�ɢϵ����������ȷ����(����)

A. ��ɢϵ�ķ��ࣺ![]()
B. ��ƽ�й�����FeCl3��Һ��Fe(OH)3���壬���Լ�������
C. ��FeCl3������Һ���뵽����������Һ�У�����ȡFe(OH)3����
D. ��ͼ��ʾ�������ֵij��أ��������붡���ЧӦ�й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
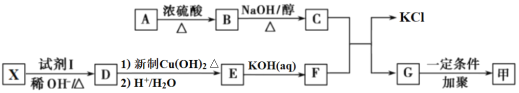
����Ŀ��������������(FeSO47H2O)��ҽҩ������Ѫ������ҵ���ɷ�������FeSO47H2O��һ��������ͼ��
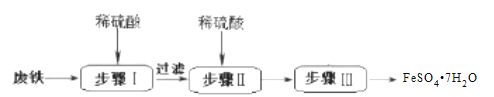
(1)�����IJ���ǰ������Ҫ�ȼ���Һ��ϴ����Ŀ����_____��
(2)��������ϡ����������ܹ�����ԭ����_____����������ϡ�����Ŀ����_____��
(3)����������������Һ�л�ü�����������(FeSO47H2O) ��ʵ�����Ϊ_____��_____��_____����ɲ������ڵ��������½��У�ԭ����_____��
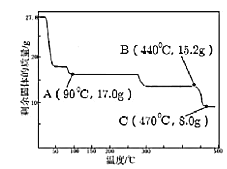
(4)ȡ27.8g FeSO47H2O��������ͬ�¶ȣ�ʣ�����������仯����ͼ��ʾ���������ݣ�90�������Ļ�ѧʽ��_____��440�桫470��ʱ�������ʷ�����Ӧ�Ļ�ѧ����ʽ��_____��������һ�жϵ�������_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com