
不同元素的原子在分子内吸引电子的能力大小可用x 表示,x越大、其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的 x 值。
| 元素 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.25 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
⑴通过分析 x 值的变化规律,确定 Mg、N 的 x 值范围:
x ( Mg ): , x ( N ): 。
⑵x 值与原子半径的大小有什么关系? , 短周期元素 x 值的变化特点体现了元素性质的 变化规律。
⑶某有机物的结构简式为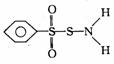 其中S―N键中你认为电子对偏向 。
其中S―N键中你认为电子对偏向 。
⑷经验规律告诉我们,当成健的两原子相应元素的 x 差值(△x)大于1.7时一般形成离子键,。△x<1.7时一般形成共价键,试判断:AlBr3中化学键的类型是 。
⑸预测元素周期表中, x 值最小的元素位置: (放射性元素除外)。
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素素素素 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
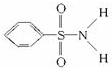 ,其中S-N中,你认为共用电子对偏向
,其中S-N中,你认为共用电子对偏向查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com