
【题目】下列说法中正确的是( )
A.金属开发和利用的历史与金属活动性的强弱密切相关
B.门捷列夫的主要贡献在于提出了原子论
C.化学是一门以实验为基础的科学,无需理论的指导
D.化学研究应该参与研究一种新物质的运动规律
科目:高中化学 来源: 题型:
【题目】NM3和D 58是正处于临床试验阶段的小分子抗癌药物,结构如下:

关于NM3和D58的叙述,错误的是
A. 都能与NaOH溶液反应,原因不完全相同
B. 都能与溴水反应,原因不完全相同
C. 都不能发生消去反应,原因相同
D. 遇FeCl3溶液都显色,原因相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修5:有机化学基础]
聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
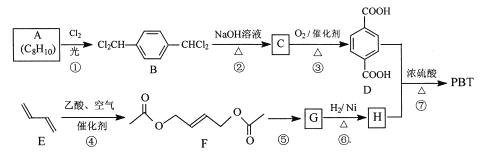
回答下列问题:
(1)A的结构简式是_________,C的化学名称是_________。
(2)⑤的反应试剂和反应条件分别是__________。
(3)F的分子式是_________,⑥的反应类型是_________。
(4)⑦的化学方程式是_________。
(5)M是H的同分异构体,同时符合_列条件的M可能的结构有_________种。
a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显不3组峰,且峰而积之比为3:1:1的结构简式是_________。
(6)以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备![]() 的合成路线:_________
的合成路线:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )
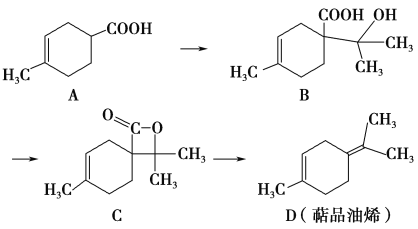
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素,原子半径的大小为:r(Y)> r(X)> r(Z),三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在在适当条件下可发生如图变化,其中B和C均为10电子分子。下列说法不正确的是( )
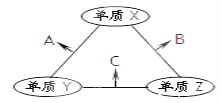
A. X元素位于ⅥA 族B. A难溶解于B中
C. A和C不可能发生氧化还原反应D. B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:Cl>S>P>Si B.共价键的极性:HF>HCI>HBr>HI
C.晶格能:NaF>NaCl>NaBr>NaI D.热稳定性:MgCO3>CaCO3>SrCO3>BaCO3
II.黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是________________。下列基态原子或离子的价层电子排布图正确的_____________。
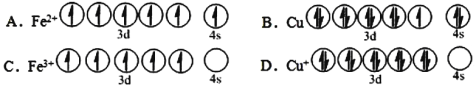
(2)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是______,中心原子杂化类型为__________,属于_______(填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是____________________。
(3)CuFeS2与氧气反应生成SO2,SO2中心原子的价层电子对数为_____,共价键的类型有_________。
(4)四方晶系CuFeS2晶胞结构如图所示。
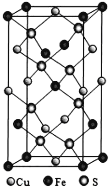
①Cu+的配位数为__________,S2-的配位数为____________。
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃的分子式为CmHn,相对分子质量为H2的39倍。它不能使酸性KMnO4溶液和溴的四氯化碳溶液褪色。在催化剂存在时,7.8 g该烃能与0.3 mol H2发生加成反应生成相应的饱和烃CmHp。则:
(1)m、n、p的值分别是m=____,n=____,p=____。
(2)CmHp的结构简式是_____________。
(3)CmHn能与浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是_______,该反应属于___反应,有机产物的名称是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室需要 1.0 mol/L 的碳酸钠溶液 450 mL,利用碳酸钠晶体(Na2CO3·10H2O)来配制。下列说法正确的是
A. 应称取该碳酸钠晶体128.7 g
B. 取 100 mL 该溶液,向其中加入100 mL 水,所得溶液浓度为0.5 mol/L
C. 定容时俯视刻度线会引起配制溶液的浓度偏高
D. 定容、摇匀、静置后发现液面低于刻度线,应再补加少量水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com