
【题目】下列食品或日常用品中主要成分是天然高分子化合物的是
A.涤纶B.花生油C.真丝睡衣D.保鲜膜
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中错误的是( )
A.氯气可用于自来水的消毒
B.四氧化三铁常用作红色油漆和涂料
C.明矾可用于净水
D.过氧化钠用于呼吸面具和潜水艇里氧气的来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市中考化学实验操作考试有四个考题:①蒸馏;②H2的化学性质;③二氧化碳的制取、收集和验满;④氧气的制取、收集和验满。考试的方法是由考生抽签确定考题,小凯同学抽签后被监考老师引导至准备了下列仪器和药品的实验台前:

请回答:
(1)指出上图中仪器a的名称:_______;
(2)由实验台上提供的仪器和药品,你认为小凯抽到的是第____个考题;
(3)以下是小凯完成该实验主要操作过程的示意图。按评分标准,每项操作正确得1分,满分5分,实验完毕后小凯得了3分。请找出他失分的操作并说明原因:______________________、______________________;
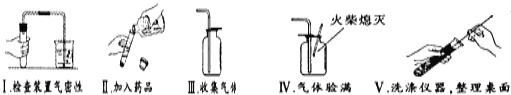
(4)仅用上述仪器(药品另选),也能完成另一种常见气体的实验室制取,化学方程式为:______________;若增加________ (填一种玻璃仪器名称)还能组装成高锰酸钾制氧气的发生装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_________。和O同一周期且元素的第一电离能比O大的有______(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)H2O分子中O原子的价层电子对数是________,CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为_______。
(3)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为_________,原因是__________。
(4)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(5)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
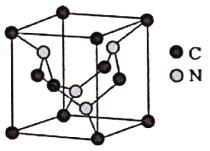
①该晶体硬度超过金刚石的原因是____________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1 molL-1CH3COOH溶液中加入少量水,溶液中 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中  增大
增大
C. 向盐酸中加入氨水至中性,溶液中 >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3溶液中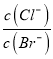 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化石墨烯具有优良的生物亲和性和亲水性,可通过下列实验方法制得(装置如图所示):
①低温阶段:控温0℃,烧瓶中加入3g石墨烯、12 g KMnO4和100 mL浓硫酸,搅拌反应20 min;
②中温阶段:水浴控温15℃,反应2 h;再控湿35℃,反应40 min;
③高温阶段:用220 mL高纯水稀释反应液,控温80℃,反应20 min,再滴入10 mL 30%H2O2溶液,控温45℃,待胶体变为金黄色,静置24 h;倾出上层清液,用盐酸洗涤下层沉淀,过滤、高纯水洗涤、真空干燥,得到氧化石墨烯。
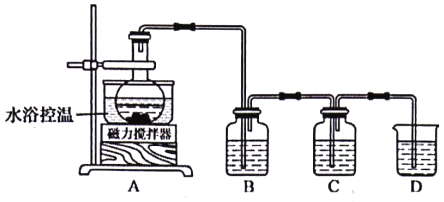
回答下列问题:
(1)将石墨中的层状结构剥离就能得到石墨烯,石墨烯的化学成分是_______(写名称)。
(2)“低温阶段”控温0℃的方法是____________。
(3)装置B装入酸性KMnO4溶液,其目的是_________;装置C用于检测CO2的生成,则判断有CO2生成的实验现象是_______________。
(4)“高温阶段”中,控温80℃之前,必须加入高纯水稀释反应液,稀释的操作方法是_______。“高温阶段”若温度过高,反应液极易发生“暴沸”而导致实验失败,其原因是__________。
(5)“高温阶段”滴入10 mL 30% H2O2溶液的目的是为了除去过量的KMnO4,反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的氧化物对环境的影响较大,CO是燃煤工业生产中的大气污染物,CO2则促进了地球的温室效应。给地球生命带来了极大的威胁。
(1)已知:①甲醇的燃烧热△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
则二氧化碳和氢气合成液态甲醇,生成液态水的热化学方程式为_____________________________。
(2)二氧化碳合成CH3OH 的热化学方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,过程中会产生副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
CO(g)+H2O(g)△H2。图1是合成甲醇反应中温度对CH3OH、CO的产率影响曲线图,△H2________0(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率___________(填“增大”“减小”或“ 不变”),副反应的化学平衡________(填“向正反应方向”“向逆反应方向”或“不”)移动。
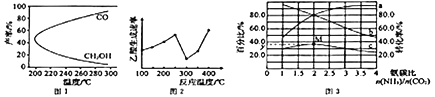
(3)以某些过渡金属氧化物作催化剂,二氧化碳与甲烷可转化为乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同温度下,乙酸的生成速率变化曲线如图2。结合反应速率,使用催化剂的最佳温度是________℃,欲提高CH4的转化率,请提供一种可行的措施:____________________________。
(4)一定条件下,CO2 与NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某温度下。在容积为1L的恒容密闭容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
的3molCO2 和NH3的混合气体。图3是有关量的变化曲线,其中表示NH3转化率的是曲线________(填“a”或“b”),曲线c 表示尿素在平衡体系中的体积分数变化曲线,则M点的平衡常数K=________,y=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是
A. 新平衡体系中,SO2和O2物质的量之比仍为2∶1
B. 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小
C. 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大
D. 若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com