
【题目】化学己经渗透到人类生活的方方面面。下列说法不正确的是
A. 为加快漂白精的漂白速率,使用时可滴加几滴醋酸
B. 明矾![]() 溶于水会形成胶体,因此可用于自来水的杀菌消毒
溶于水会形成胶体,因此可用于自来水的杀菌消毒
C. 月饼因富含油脂而易发生氧化,保存时常放入装有铁粉的透气袋作抗氧化剂
D. 为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C
科目:高中化学 来源: 题型:
【题目】下列说法或表达式正确的是( )
A. 0.5mol 稀 H2 SO 4与0.5mol 稀 Ba (OH )2溶液反应放出akJ热量,则中和热为 akJ/ mol
B. 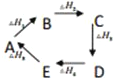 则热量变化关系式: △H1+△H3+△H5=-(△H2+△H4)
则热量变化关系式: △H1+△H3+△H5=-(△H2+△H4)
C. △H与反应方程式中的化学计量数,物质的状态和可逆反应均有关
D. 同温同压下, H2( g)+ Cl 2(g)= 2HCl (g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
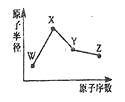
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,将一定量的混合气体在密闭容器中发生反应:aA(g)+bB(g) ![]() cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol·L-1。恒温下,将密闭容器的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol·L-1。下列叙述中正确的是
A. 重新达到平衡时,D的体积分数减小 B. a+b<c+d
C. 重新达到平衡时,A气体的浓度增大 D. 平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A~R 10种元素在周期表中的位置(填元素符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | E | J | F | |||||
3 | A | C | D | G | R | |||
4 | B | H |
i. 请填空:
(1)这10种元素中,化学性质最不活泼的是____(填元素符号)。
(2)D元素最高价氧化物对应的水化物与氢氧化钠反应的离子方程式是____。
(3)A、B、C三种元素按原子半径由大到小的顺序排列为____(填元素符号)。
(4)EF2的电子式为____,F元素的最简单氢化物在常温下跟B发生反应的化学方程式是____。
(5)G元素和H元素两者核电荷数之差是____。
ii. 元素J的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
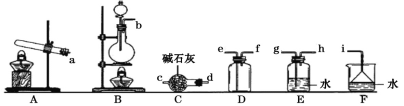
①只用固体药品制备氨气的发生装置可以选择上图中的____,反应的化学方程式为____。
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→____(按气流方向,用小写字母表示)。
③将上述收集到的NH3充入无色透明烧瓶中,并加入少量催化剂,然后充入NO2。常温下反应一段时间后的实验现象为____,反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
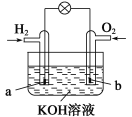
A.a极是负极,该电极上发生氧化反应
B.b极反应是O2+4OH--4e-===2H2O
C.总反应方程式为2H2+O2===2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等.
Ⅰ.(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H 1=-1411KJmol-1
②C3H6(g)+![]() O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H 3=-2539KJmol-1
“烯烃歧化法”的反应的热化学方程式为_____________________。
(2)一定温度下,在一体积恒为 V 升的密闭容器中充入一定量的 C4H8 和 C2H4,发生烯烃歧化法的 主要反应。 t1 时刻达到平衡状态,此时容器中 n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=b mol, 且 C3H6 占平衡总体积的 1/4。
①求该时间段内的反应速率 v(C4H8)=_____________。 (用只含 a、V、t1 的式子表示)
②判断该反应达到平衡的标志是______________
A.2v (C4H8) 生成=v (C3H6) 消耗
B.C4H8、C2H4、C3H6 的物质的量之比为 1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6 的浓度均不再变化
(3)Kp 是用反应体系中气体物质的分压来表示的平衡常数,即将 K 表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)![]() 2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
Ⅱ.“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生.反应如下主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋 势分别如图 1 和图 2 所示:
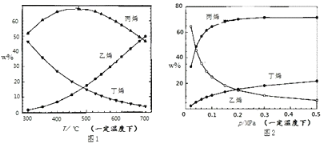
(1)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图 1 和图 2 中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号).
A.300oC 0.1MPa B.700oC 0.1MPa C.300oC 0.5MPa D.700oC 0.5MPa
(2)有研究者结合图 1 数据并综合考虑各种因素,认为 450℃的反应温度比 300℃或 700℃更合适, 从反应原理角度分析其理由可能是________________.
(3)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲和乙是双液原电池装置。由图可判断下列说法错误的是( )

A. 乙图电池反应的离子方程式为:Co(s)+2Ag+(aq)=2Ag(s)+Co2+(aq)
B. 反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq) 不能发生
C. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D. 甲图当有1mol电子通过外电路时,正极有59g Co析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com