
【题目】按要求回答下列问题:
(1)将28.5 g氯化镁溶于水配成的500 mL溶液中Cl浓度是 ,写出氯化镁的电离方程式 。
(2)已知m mol某气体的质量为a g,则b g该气体在标准状况下的体积为 L。
(3)某Al2(SO4)3溶液V mL中含有Al3+a g,取出![]() mL溶液稀释成V mL后,
mL溶液稀释成V mL后,![]() 的物质的量浓度为 (用含a、V的代数式表示,化简到最简整数比)。
的物质的量浓度为 (用含a、V的代数式表示,化简到最简整数比)。
(4)以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④铝 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融KNO3,其中属于电解质的是 (填编号,下同),能导电的是 。
【答案】(7分)(1)1.2 mol/L(1分) MgCl2![]() Mg2++2Cl(1分)
Mg2++2Cl(1分)
(2)22.4mb/a(1分)
(3)![]() mol/L(2分)
mol/L(2分)
(4)①③⑤⑧(1分) ④⑧(1分)
【解析】(1)28.5 g氯化镁的物质的量为![]() =0.3 mol,其中Cl的物质的量为0.3 mol×2 =0.6 mol,将该氯化镁溶于水配成的500 mL溶液中Cl浓度为
=0.3 mol,其中Cl的物质的量为0.3 mol×2 =0.6 mol,将该氯化镁溶于水配成的500 mL溶液中Cl浓度为![]() =1.2 mol/L;氯化镁的电离方程式为MgCl2
=1.2 mol/L;氯化镁的电离方程式为MgCl2![]() Mg2++2Cl。
Mg2++2Cl。
(2)m mol某气体的质量为a g,则该气体摩尔质量为![]() =
=![]() g/mol,b g该气体的物质的量为
g/mol,b g该气体的物质的量为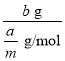 =
=![]() mol。在标准状况下,该气体的体积为
mol。在标准状况下,该气体的体积为![]() mol×22.4 L/mol=
mol×22.4 L/mol=![]() L。
L。
(3)a g Al3+的物质的量为![]() =
=![]() mol,溶液中n(Al3+)∶n(
mol,溶液中n(Al3+)∶n(![]() )=2∶3,V L溶液中n(
)=2∶3,V L溶液中n(![]() )=
)=![]() mol×
mol×![]() =
=![]() mol,故
mol,故![]() mL溶液中n(
mL溶液中n(![]() )=
)=![]() mol×
mol×![]() =
=![]() mol,故稀释后溶液中
mol,故稀释后溶液中![]() 物质的量浓度为
物质的量浓度为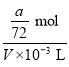 =
=![]() mol/L=
mol/L=![]() mol/L。
mol/L。
(4)所给物质中,属于电解质的有①③⑤⑧,能导电的有④⑧。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究合成氨反应有重要意义,请完成下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。C(s)+H2O(g)![]() H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
H2(g)+CO(g) ΔH=+131.3kJ·mol-1,ΔS=+133.7J·mol-1·K-1,
①该反应在低温下___________(填“能”或“不能”)自发进行。
②写出该反应的平衡常数表达式_________________。
(2)已知在400℃时,N2(g)+3H2(g)![]() 2NH3(g)的K=0.5。
2NH3(g)的K=0.5。
①在400℃时,2NH3(g)![]() N2(g)+3H2(g)的K′=________(填数值)。
N2(g)+3H2(g)的K′=________(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正________v(N2)逆(填“>”、“<”、“=”或“不能确定”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡________移动(填“向左”、“向左”或“不”);反应的ΔH__________(填“增大”、“减小”或“不改变”)。
(3)水煤气转化反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
CO2(g)+H2(g)在一定温度下达到化学平衡。现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下两组教据:
实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
① 实验l中以CO2表示的反应速率为v(CO2)=____________;
② 实验1的平衡常数K1__________实验2的平衡常数K2(填“大于””小于,“等于”“不能确定”)。
③ 该反应正方向为_____________(填“吸”或‘放”)热反应;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属易腐蚀,下列金属的防护方法不合理的是
A. 在衣架和电线外面包上一层塑料层 B. 在船身下方连接铜块
C. 健身器材表面刷油漆 D. 在钢制品外层镀上铬
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离苯和苯酚的混合物,通常采用的方法是
A. 振荡混合物,用分液漏斗分离
B. 加入NaOH溶液后振荡,用分液漏斗分离;取下层液体通入CO2,待分层后分液
C. 加水振荡后用分液漏斗分离
D. 加稀盐酸振荡后,用分液漏斗分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关天然产物水解叙述不正确的是( )
A. 油脂水解可得丙三醇 B. 纤维素水解和淀粉水解得到的最终产物不同
C. 蛋白质水解的最终产物均为氨基酸 D. 可用碘检验淀粉是否水解完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析不正确的是
A. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC![]() 为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl
为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl![]() 能与B、C的氢化物形成六配位的配合物,且B、C的氢化物物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
能与B、C的氢化物形成六配位的配合物,且B、C的氢化物物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为 。
(2)A的氢化物中一种组成为A2H2分子,此分子A中原子轨道的杂化类型为 ,1 mol A2H2含σ键的数目为 。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的价电子排布式是 ,ECl3与B、C的氢化物形成的配合物的化学式为
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com