
【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,利用该废液制备过二硫酸铵[(NH4)2S2O8]和TiO(OH)2的一种工艺流程如下:
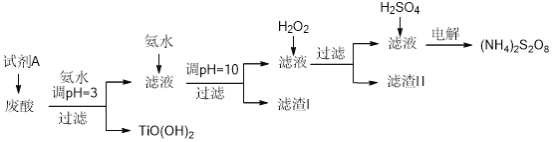
已知:i.
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)试剂A为__________,其作用是____________。
(2)取少量TiO(OH)2,用稀盐酸溶解,滴加少量KSCN溶液后无明显现象。再加入少量H2O2,出现微红色。焙烧TiO(OH)2获得的TiO2会发黄,发黄的杂质可能是__________(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有__________(填化学式)。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++_____+4H2O+H2O2=______+4NH3·H2O
(5)过二硫酸铵中硫元素的化合价为__________。
(6)常温下,含硫微粒主要存在形式与 pH的关系如下图所示。
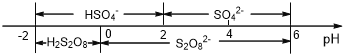
用惰性电极电解饱和NH4HSO4溶液制备过二硫酸铵时,在阳极放电的离子主要为HSO4-,则阳极区电解质溶液的pH范围为____<pH<____,其电极反应式为____________
【答案】铁粉 将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀 Fe2O3 Fe(OH)3 4OH- 2Fe(OH)3![]() +6 0 2 2HSO4--2e-=S2O82-+2H+
+6 0 2 2HSO4--2e-=S2O82-+2H+
【解析】
废酸中主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,利用该废液制备过二硫酸铵[(NH4)2S2O8]和TiO(OH)2。根据流程图,用氨水调节pH=3得到TiO(OH)2,而此时铁离子也会形成沉淀,因此需要将铁离子转化为亚铁离子,因此试剂A为铁粉;滤液中加入氨水调节pH=10,得到的沉淀有氢氧化亚铁和氢氧化铝(滤渣I);滤液中含有部分Fe(II)氨络离子[Fe(NH3)2]2+,因此加入双氧水将亚铁离子氧化形成氢氧化铁沉淀(滤渣II);再在滤液中加入硫酸酸化后电解得到过二硫酸铵[(NH4)2S2O8]。据此分析解答。
(1)根据上述分析,试剂A为铁粉,主要作用是将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀,故答案为:铁粉;将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀;
(2)取少量TiO(OH)2,用稀盐酸溶解,滴加少量KSCN溶液后无明显现象。再加入少量H2O2,出现微红色,说明溶液中含有少量Fe3+。因此焙烧TiO(OH)2获得的TiO2会发黄,发黄的杂质为Fe2O3,故答案为:Fe2O3;
(3)根据(2)的提示,滤液中还含有少量的Fe3+,且pH=3时,铁离子不能完全沉淀,因此pH=10时产生的滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有少量的Fe(OH)3,故答案为:Fe(OH)3;
(4)在碱性溶液中,加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+得到氢氧化铁沉淀,根据化合价升降守恒,配平后的离子方程式为2[Fe(NH3)2]2++4OH-+4H2O+H2O2=2Fe(OH)3![]() +4NH3·H2O,故答案为:4OH-;2Fe(OH)3
+4NH3·H2O,故答案为:4OH-;2Fe(OH)3![]() ;
;
(5)过二硫酸铵[(NH4)2S2O8]中N元素为-3价,H元素为+1价,O元素为-2价,根据正负化合价的代数和为0,得到硫元素的化合价为+6,故答案为:+6;
(6)根据常温下,含硫微粒主要存在形式与 pH的关系图,阳极放电的离子主要是HSO4-,则阳极区电解质溶液的pH范围应控制在0~2,阳极发生氧化反应,HSO4-放电转化为S2O82-,则阳极的电极反应为:2HSO4--2e-═S2O82-+2H+,故答案为:0;2;2HSO4--2e-═S2O82-+2H+。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH = -lg[OH-])与pH的变化关系如图所示,则

A. M点所示溶液导电能力强于Q点
B. N点所示溶液中c(CH3COO-)﹥c(Na+)
C. M点和N点所示溶液中水的电离程度相同
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
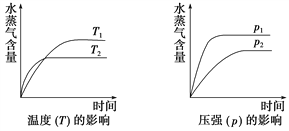
A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、B:![]() 、C:CH3COOH。
、C:CH3COOH。
(1)写出化合物A、C中官能团的名称:___________、_______。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是______(写名称),该反应的化学方程式为____。该物质在农业上用作水果的________。
(3)B的名称是_______,它的分子具有______(填分子构型)结构,是否存在单双键交替结构?___(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用中和热的测定方法,即保温、隔热条件下,向盛有20 mL 2.08 mol·L-1的NaOH溶液的试管中分五次加入1—5 mL未知浓度的H2SO4溶液(边加边振荡,每次加入1 mL)后,测得溶液的温度分别是1.4 ℃、2.5 ℃、4.2 ℃、5.2 ℃、5.18 ℃,则该硫酸溶液的物质的量浓度是
A. 20.8 mol·L-1 B. 5.2 mol·L-1 C. 6.9 mol·L-1 D. 4.16 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g)△H=-746.8kJmol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 及时将CO2和N2从反应体系中移走
C. 升高温度同时充入N2 D. 增大压强同时加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是最重要的铜矿,全世界三分之二的铜是由它提炼的。
铜矿冶炼过程中发生的反应有:2CuFeS2+O2=Cu2S+2FeS+SO2 ;2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2
回答下列问题:
(1)Cu属于_____区的元素,黄铜矿中铜离子基态外围电子排布式为_____________。
(2)铜矿冶炼过程中产生的SO2可用于生产硫酸,SO2的空间构型为___________,中心原子的杂化方式为__________。冶炼过程还产生了Cu2S 、Cu2O,其中熔点较高的是______________,原因是_______________。
(3)黄铜矿不溶于稀硫酸,但可以溶解在稀硝酸中,硝酸将其中的铁、硫元素氧化到高价态,可以用黄血盐K4[Fe(CN)6]检验Fe3+的存在,1 mol K4[Fe(CN)6]中含有的σ键的数目为_______________。
(4)Cu2O晶体的晶胞如图所示,晶胞的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则Cu原子配位数为__________,最近的两个O原子之间的距离为____________nm。
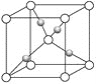
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
A. 2 mol N2和6 mol H2 B. 1 mol N2和2 mol NH3
C. 1 mol N2、3 mol H2和2 mol NH3 D. 2 mol N2、3 mol H2和1 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂可以加快反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com