
分析 实验I:Na2SO3浓溶液中+4价的硫易被氧化成+6价,选择BaCl2稀溶液,可用来检验硫酸根离子的存在;
实验II:Fe3+和SO32-之间若发生氧化还原反应,则溶液的颜色由黄色逐渐变为亚铁离子的绿色,而实验现象证明未发生氧化还原反应,应该发生双水解反应,所以出现的红褐色的液体应是氢氧化铁胶体(或胶体);向胶体中加入电解质溶液,胶体会发生聚沉现象,所以有红褐色沉淀生成;继续滴加盐酸,因为盐酸与氢氧化铁沉淀反应,所以沉淀逐渐溶解最终消失,溶液变黄色,同时盐酸与亚硫酸钠反应有气体生成;KSCN溶液与铁离子发生络合反应,生成硫氰化铁;另一份加入BaCl2稀溶液,有少量白色沉淀生成,因为亚硫酸根离子与盐酸反应了,所以溶液中不存在亚硫酸根离子,所以此时产生的白色沉淀应是硫酸钡沉淀;
实验III:由以上实验现象分析,Fe3+和SO32-之间同时发生氧化还原反应和双水解反应;FeCl3浓溶液中加入Na2CO3溶液,则二者只发生双水解反应,生成氢氧化铁沉淀和二氧化碳气体;
①从化合价上判断CO32-离子中的C元素是+4价为最高价,无还原性,不可能与Fe3+发生氧化还原反应;而SO32-离子中的S元素是+4价,为中间价态,具有还原性,可与Fe3+发生氧化还原反应;
②从水解程度判断,碳酸的酸性比亚硫酸的酸性弱,所以CO32-离子水解程度大于SO32-离子的水解程度,CO32-离子与Fe3+发生双水解反应比较彻底.
解答 解:实验Ⅰ:该同学选择的药品中有BaCl2稀溶液,用来检验硫酸根离子的存在,所以实验I的目的是检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4),
故答案为:检验Na2SO3是否变质(或检验Na2SO3溶液中是否混有Na2SO4);
实验Ⅱ:FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,铁离子能够与亚硫酸根离子发生水解生成了红褐色的氢氧化铁胶体;向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生;
加入KSCN溶液,溶液变为血红色,反应反应的离子方程式为:Fe3++3SCN-═Fe(SCN)3;
加入氯化钡生成白色沉淀,白色沉淀为硫酸钡,反应的离子方程式为:Ba2++SO42-═BaSO4,
故答案为:氢氧化铁胶体(或胶体);先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生;Fe3++3SCN-═Fe(SCN)3;Ba2++SO42-═BaSO4↓;
实验Ⅲ:换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同,证明了Fe3+与SO32-发生氧化还原反应和双水解反应是同时进行的,在FeCl3浓溶液中加Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,二者发生了双水解反应,反应的离子方程式为:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑;
故答案为:Fe3+与SO32-同时发生氧化还原反应和双水解反应;2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑;
①CO32-离子中的C元素是+4价为最高价,无还原性,不可能与Fe3+发生氧化还原反应,由于亚硫酸根离子具有较强的还原性,能够与铁离子发生氧化还原反应,
故答案为:SO32-有较强的还原性,CO32-没有还原性;
②铁离子与亚硫酸根离子生成了氢氧化铁胶体,与碳酸根离子反应生成了氢氧化铁沉淀,说明碳酸根离子水解能力比亚硫酸根离子大,
故答案为:SO32-水解能力较CO32-小.
点评 本题考查了铁及其化合物性质的分析应用,考查对实验原理、实验现象的分析判断,氧化还原反应、双水解反应的应用,离子方程式的书写,掌握物质性质和反应现象是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.
常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
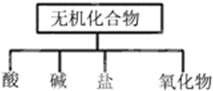
| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②HNO3 | ③NaOH、KOH或NH3•H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥NaNO3、Na2SO4或NH4NO3 | ⑦CO2 ⑧Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2 | B. | CH3CH═CH2 | C. | CH3CH2CH═CH2 | D. | CH3CH2CH2CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第17.18列元素都是非金属元素 | |
| B. | 第14列元素形成的化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
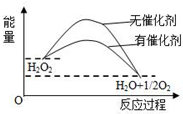
| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图,请读题并填空:在图中,
如图,请读题并填空:在图中,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.
将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验 | |
| B. | 鉴别溶液中是否有SO42-,用盐酸酸化 | |
| C. | 为抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com