
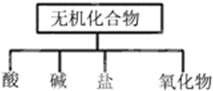
| 物质 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ②HNO3 | ③NaOH、KOH或NH3•H2O ④Ba(OH)2 | ⑤Na2CO3 ⑥NaNO3、Na2SO4或NH4NO3 | ⑦CO2 ⑧Na2O |
分析 (1)根据交叉分类法和树状分类法的定义判断;
(2)以H、O、S、N、Na五种元素中任意两种或三种元素可组成酸、碱、盐、氧化物等,根据常见的物质书写;
(3)根据二氧化碳可以与氧化钠反应生成碳酸钠;
(4)根据CO2的检验方法:把气体通入澄清的石灰水,石灰水变浑浊,说明气体为二氧化碳.
解答 解:(1)交叉分类法含义:根据物质不同的分类标准,对同一事物进行多种分类的一种分类方式,树状分类法含义:对同一类事物按照某些属性进行在分类的分类法,无机化合物可根据其组成和性质进行分类:无机化合物、盐、碱、酸、氧化物、氢化物属于树状分类法;
故答案为:树状分类法;
(2)以H、O、S、N、Na五种元素中任意两种或三种元素可组成酸有:H2SO4或HNO3,碱有:NaOH、KOH或NH3•H2O,
盐有:NaNO3、Na2SO4、NH4NO3,氧化物有:H2O、NO、NO2、N2O5、SO2、SO3、Na2O,氢化物有:NH3,H2O等,
故答案为:②HNO3 ③NaOH、KOH或NH3•H2O ⑥NaNO3、Na2SO4、NH4NO3(任写一种);
(3)因CO2能与氧化钠反应生成碳酸钠:Na2O+CO2═Na2CO3;
故答案为:Na2O+CO2═Na2CO3;
(4)检验二氧化碳气体,把气体通入澄清的石灰水,石灰水变浑浊,说明气体为二氧化碳;
故答案为:将气体通入澄清的石灰水中,变浑浊,则说明该气体是二氧化碳.
点评 本题考查物质的分类,题目难度不大,注意H、O、S、N、Na五种元素常见的物质的存在形式,以及物质的分类方法.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
 在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.
在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3克金属钠在干燥空气中被氧化成氧化物时失去的电子数目为0.1NA | |
| B. | 18克水所含的质子数目为NA | |
| C. | 在常温常压下,11.2升氯气所含的分子数目为0.5NA | |
| D. | 32克臭氧所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com