
【题目】下列关于硫酸的叙述中正确的是( )
A.浓硫酸、稀硫酸都难挥发
B.浓硫酸、稀硫酸都能氧化金属锌,且反应实质相同
C.浓硫酸、稀硫酸在加热时都能与铜反应
D.浓硫酸、稀硫酸在常温下都能用铁制容器贮存
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某抗癌新药H的一种合成路线如下:
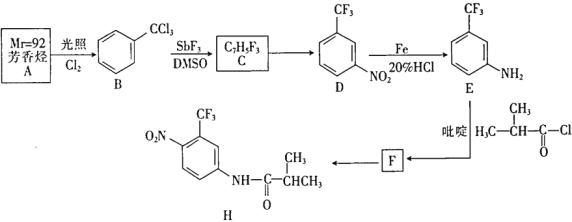
回答下列问题:
(1)A的名称是____________。
(2)B→C的反应类型是__________________。
(3)吡啶的结构简式为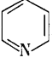 具有碱性,在E→F中吡啶的作用是_________________。
具有碱性,在E→F中吡啶的作用是_________________。
(4)写出E→F的化学方程式_____________。
(5)T(C7H7NO2)是E在碱性条件下的水解产物,同时符合下列条件的T的同分异构体有______种。
①-NH2直接连在苯环上;②能与新制氢氧化铜悬浊液共热产生红色固体
其中,在核磁共振氢谱上有4个峰且峰的面积比为1:2:2:2的结构简式为_________________。
(6)以CH3CH2COCl和![]() 为原料,经三步合成某化工产品(
为原料,经三步合成某化工产品(![]() )路线为(无机试剂任选):___________________。
)路线为(无机试剂任选):___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在进行中和热的测定时,下列操作错误的是( )
A.反应前酸、碱溶液的温度要相同
B.为了使反应均匀进行,可向酸(碱)中分次加入碱(酸)
C.测量溶液的温度计要一直插在溶液中
D.为了使反应更完全,可以使酸或碱适当过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ/moL、497kJ/mol。N2 (g)+ O2 (g)=2NO(g) H=+180.0kJ/moL。则相同条件下破坏1molNO中化学键需要吸收的能量为_____kJ.
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的氢离子浓度c(H+)=_____mol/L。
若加入少量NaOH固体,则溶液中![]() _____(填"增大”、“减小”或“不变”)。
_____(填"增大”、“减小”或“不变”)。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其含碳元素的微粒物质的量分数(ψ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32- ____(填“能”或“不能”)大量共存。
②pH=12时,Na2CO3溶液中物料守恒关系为______。当pH=7时,溶液中含碳元素的微粒主要为_________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=_____。
HCO3-+OH-的平衡常数Kh=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对社会发展与进步有巨大贡献。
(1)某温度下,在容积均为2L的两个密闭容器中分别发生反应。N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0kJ/mol。相关数据如下:
2NH3(g) △H=-92.0kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1molN2(g)和3molH2(g) | 2molNH3(g) |
平衡时c(NH3) | c1 | c2 |
平衡时能量变化 | 放出18.4kJ | 吸收akJ |
①下列情况能说明该反应一定达到中平衡状态的是_____(填字母)。
A.3v(N2)正=v(H2)逆 B.N2、H2的浓度之比不再随时间改变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子质量不变
②其他条件不变,达到平衡后,下列不能提高H2转化率的操作是_____ (填字母)。
A.升高温度 B.充入更多的H2 C.移除NH3 D.压缩容器体积
③c1__c2(填“>”“<”或“=”)。
(2)合成氨也可以采用电化学法,其原理如右图所示。则阴极的电极反应式是_________。

(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H=-906kJ/mol
4NO(g)+6H2O(g) △H=-906kJ/mol
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-1267kJ/mol
2N2(g)+6H2O(g) △H=-1267kJ/mol
①该条件下,N2(g)+O2(g)![]() 2NO(g) △H=_____kJ/mol
2NO(g) △H=_____kJ/mol
②为分析催化剂对反应的选择性,在1L密闭容器中充入1molNH3和2molO2,在一定时间内测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应___填“反应I”或“反应II”)。当温度高于840℃时,反应I中NO的物质的量减少的原因是________。520℃时,反应I的平衡常数K=____(只列算式不计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属。所以钴及其化合物具有重要作用,回答下列问题:
(1)基态Co原子的电子排布式为___________。
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是__________。
②[Co(NH3)5H2O]Cl3中Co元素化合价为____,其配位原子为_____;1mol该晶体中含有____molσ键。
③H2O2中O原子的杂化轨道类型是______,H2O2能与水互溶,除都是极性分子外,还因为____。
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是________。
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为_____;该晶胞中原子的空间利用率为__________(用含a、b的计算式表示)。
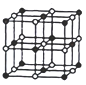
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序数依次增大。已知:T与U、V同周期,W与X、Y、Z同周期,U和Y同族;元素Q的某种核素没有中子;元素T的最高正价与最低负价的代数和为0;Q与U形成的气态化合物相对分子质量为17;工业上通过分离液态空气获得V的单质,且该单质的某种同素异形体是保护地球地表环境的重要屏障;W、X、Z的最高价氧化物对应的水化物两两之间都能反应,且W、X、Z原子最外层电子数之和等于W的原子序数。
(1)Z元素原子的 L层电子数为______,元素 Y的原子结构示意图___________,T的一种核素在考古时常用来鉴定一些文物的年代,用的核素是___________(填核素符号)。
(2)元素Q与V可以形成18电子化合物的其电子式为_________,元素W与Q形成的化合物的类型_____________(填‘离子化合物’或‘共价化合物’)。
(3)V的氢化物比同主族其他元素的氢化物的熔沸点明显偏高,原因是___________。
(4)写出X、W 两种元素最高价氧化物对应的水化物相互反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100 mL的CaSO4饱和溶液中,加入400 mL 0.01 mol·L-1的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)
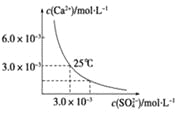
A. 溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B. 溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C. 溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO 42-)都变小
D. 溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com