
【题目】请按下列要求填空:
(1)已知99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)常温下,HNO2 的电离常数Ka=7.1×10-4mol·L-1,NH3·H2O的电离常数Kb=1.7×10-5mol·L-1。0.1mol·L-1 NH4NO2 溶液中离子浓度由大到小的顺序是__________________
(3)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图所示。

① 乙烯电子式为_________
②b电极的名称是_________
③请写出电解时生成乙烯的电极反应式____________________________
【答案】 H2A=2H++A2- C c(NH4+)>c(A2-)>c(H+)>c(OH-) c(NO2- )>c(NH4+)>c(H+ )>c(OH-) ![]() 正 2CO2+12H++12e-=C2H4+4H2O
正 2CO2+12H++12e-=C2H4+4H2O
【解析】(1)99 ℃时,水的离子积常数Kw=1.0×10-12,=c2(H+),c(H+)=![]() =1.0×10-6,中性时pH=6。该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,Na2A是强酸强碱盐。①H2A是强酸,在水溶液中的电离方程式为 H2A=2H++A2- ,②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,n(H+)=c(H+)×V,氢离子浓度和体积相同,产生的氢气相同,故选C。③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,生成(NH4)2A,在水中电离成NH4+、A2-, NH4+水解使溶液呈酸性,溶液中各离子浓度从大到小的顺序为c(NH4+)>c(A2-)>c(H+)>c(OH-);(3)① 乙烯碳与碳形成双键,电子式为
=1.0×10-6,中性时pH=6。该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,Na2A是强酸强碱盐。①H2A是强酸,在水溶液中的电离方程式为 H2A=2H++A2- ,②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,n(H+)=c(H+)×V,氢离子浓度和体积相同,产生的氢气相同,故选C。③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,生成(NH4)2A,在水中电离成NH4+、A2-, NH4+水解使溶液呈酸性,溶液中各离子浓度从大到小的顺序为c(NH4+)>c(A2-)>c(H+)>c(OH-);(3)① 乙烯碳与碳形成双键,电子式为![]() ;②b电极上水失去电子产生氧气,故b电极名称是正极;③电解时生成乙烯的电极反应式2CO2+12H++12e-=C2H4+4H2O。
;②b电极上水失去电子产生氧气,故b电极名称是正极;③电解时生成乙烯的电极反应式2CO2+12H++12e-=C2H4+4H2O。


科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组请你参与“研究铁与水蒸气反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:

探究一:设计如图所示装置进行“铁与水蒸气反应”的实验(夹持仪器略) 。
(1)硬质玻璃管 B 中发生反应的化学方程式为:________________________________。
(2)装置 D的作用是_______________________。
探究二:设计如下实验方案确定反应后硬质玻璃管B 中黑色固体的成分(已知酸性KMnO4溶液能与盐酸发生反应)。
(3)待硬质玻璃管 B 冷却后,取少许其中的固体物质继续进行如下实验:
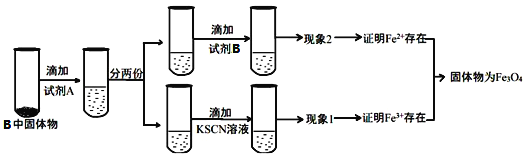
①试剂A是________,现象2为___________________ 。
②若现象1中溶液未变血红色,请从硬质玻璃管B中固体物质的成分分析可能的原因:________________________________________________________________________。
探究三:某学习小组设计用硬质玻璃管B中固体制备Fe3O4纳米材料的流程示意图如下:
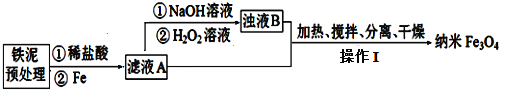
已知:①浊液B中铁元素以FeOOH形式存在;
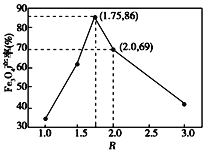
②在操作I中,相同条件下测得Fe3O4的产率与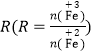 的关系如下图所示。
的关系如下图所示。
(4)在滤液A转化为浊液B反应完成后需再加热一段时间除去剩余H2O2,目的是_________。
(5)设浊液B中FeOOH的物质的量为amol,滤液A中的铁元素的物质的量为bmol。为使Fe3O4的产率最高,则![]() =_________。(填数值,保留3位有效数字)
=_________。(填数值,保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的取用说法不正确的是( )
A.胶头滴管可用来取用少量液体试剂B.无毒的固体试剂可用手直接取用
C.多取的钠可放回原试剂瓶中D.取用固体试剂时,可用药匙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质的叙述正确的是
A.能在熔化状态下导电的物质,属于电解质
B.在液态不导电的化合物,一定是非电解质
C.固态的硝酸钾不导电是因为没有离子
D.CO2的水溶液能导电,所以H2CO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关酶的叙述中,正确的是
A.酶的催化效率总是高于无机催化剂
B.一个酶分子只起一次作用
C.酶催化反应能放出更多的能量
D.催化蛋白质水解的酶的化学本质是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热 42g NaHCO3 和 Na2CO3 固体混合物,至没有气体放出时,剩余的固体质量是 35.8 g。那么原固体混合物中Na 2CO3 的质量是
A. 25.2g B. 16.8 g C. 10.6 g D. 24.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素基态原子的电子排布式为[Ar]3d74s2,它在元素周期表中的位置是( )
A. 第3周期ⅡB族B. 第4周期ⅡB族C. 第4周期ⅦB族D. 第4周期Ⅷ族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com