
| n |
| V |


科目:高中化学 来源: 题型:
| A、少开汽车可一定程度地减缓雾霾现象 |
| B、为提高作物产量大量使用农药和化肥 |
| C、使用无磷洗衣粉能缓解水体富营养化 |
| D、合理利用可燃冰有利于弥补能源短缺 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、做“钠与水的反应”实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 |
| B、单晶硅是将太阳能转变为电能的常用材料 |
| C、二氧化硫、氮氧化物、总悬浮颗粒物属于大气监测,空气质量日报的内容 |
| D、一旦金属汞洒落,必须尽可能收集起来,放在水中保存以防挥发;并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) 浓度(mol?L-1) | 0 | 5 | 10 | 15 | 20 | 25 |
| NO | 1.00 | 0.60 | 0.40 | 0.40 | 0.52 | 0.52 |
| N2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
| CO2 | 0 | 0.20 | 0.30 | 0.30 | 0.39 | 0.39 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
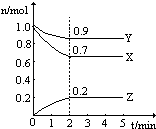 温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:
温度一定,在一个10L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.试根据图中数据,填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ||
| B | C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | C | |
| B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com