
【题目】某强氧化性离子XO(OH)2+可被Na2SO3还原。如果还原2.4×10-3mol XO(OH)2+,需用30mL 0.2 mol·L-1的Na2SO3溶液,那么X元素被还原后的价态是( )
A. +2 B. 0 C. +1 D. -1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。


据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的4 L密闭容器中,X、Y、W 3种气体起始状态和平衡状态时的物质的量如下表所示。下列说法正确的是
气体 | X | Y | W |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A. 此反应的平衡常数表达式为K=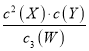
B. 达到平衡后,升高温度,W的体积分数减小,则此反应的△H>0
C. 达到平衡后,将容器体积压缩为2 L,W的物质的量浓度变为0.75mol·L-1
D. 达到平衡后,增大压强,正、逆反应速率均增大,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的生产生活离不开金属材料,金属及金属材料在生产、生活中应用广泛.
(1)生活中常用的铁锅炒菜,主要是利用了铁的;铁在潮湿的空气中容易锈蚀,喷漆可以延缓汽车钢铁外壳的锈蚀,起防锈原理是隔绝 , 喷漆前需将铁制品放入稀盐酸中除锈(铁锈主要成分是Fe2O3),观察到溶液变黄,有无色气泡逸出,写出其中涉及到的一个化学方程式: .
(2)化学实验室要从含少量铜粉的银、锰(Mn)混合金属粉末中分离出贵金属,并获得一种盐晶体,将有关三种金属随意编号为:A、B、C,并设计了如下流程: 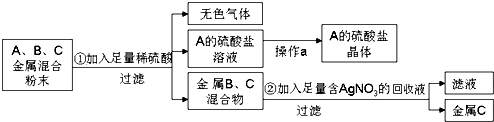
①A、B、C三种金属的活动性顺序为 .
②金属C是 , 已知A的硫酸盐中A元素显+2价,请写出步骤①的反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:

已知2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用![]() 还原
还原![]() 制备金属
制备金属![]() 的装置如图所示(
的装置如图所示(![]() 粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )
粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )

A. ①、②、③中依次盛装![]() 溶液、浓
溶液、浓![]() 、焦性没食子酸溶液
、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞![]() ,再停止加热
,再停止加热
D. 装置![]() (启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com