


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
|
| 1 |
| 2 |
|
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
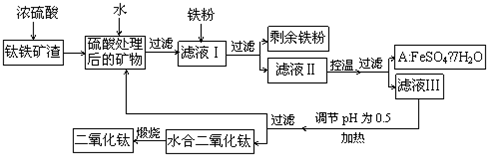
查看答案和解析>>
科目:高中化学 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
钛被认为是21世纪的重要金属材料.纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用.
Ⅰ.目前大规模生产钛的方法是:
第一步 首先将金红石(TiO2)、炭粉混合,在高温条件下通入氯气制得TiCl4;
第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛.
已知:①C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)
ΔH=-566 kJ·mol-1③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则
:TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________.Ⅱ.
纳米TiO2可通过TiCl4水解制备,过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1 mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2.(1) TiCl4水解生成TiO2·x H2O的化学方程式为________.
(2)简述升温和调节溶液pH的目的:________.
Ⅲ.在制造TiO2过程中,需要测定Ti(Ⅳ)的含量.测定时首先将TiO2溶解为钛液,然后取10 mL用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应:
Ti(Ⅳ)+Al→Ti3++Al3+.过滤后,取出滤液20 mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1 mol/L FeCl3溶液,终点到来时,用去了30 mL的FeCl3溶液.
(1)滴定终点的现象是________.
(2)原钛液的物质的量浓度为________.
(3)若在滴定终点读取滴定管刻度时,俯视标准液液面,则使Ti(Ⅳ)的含量测定结果________(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(10分)钛被认为是21世纪的重要金属材料。纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
Ⅰ.目前大规模生产钛的方法是:第一步 首先将金红石(TiO2)、炭粉混合,在高温条件下通入氯气制得TiCl4;第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛。
已知:① C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ② 2CO(g)+O2(g)=2CO2(g)
△H=-566kJ·mol-1 ③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ·mol-1
则:TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
Ⅱ.纳米TiO2可通过TiCl4水解制备,过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2。⑴TiCl4水解生成TiO2·x H2O的化学方程式为_____________________。
⑵简述升温和调节溶液pH的目的: 。
Ⅲ.在制造TiO2过程中,需要测定Ti(Ⅳ)的含量。测定时首先将TiO2溶解为钛液,然后取10mL用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应:
Ti(Ⅳ)+Al→Ti3++Al3+。过滤后,取出滤液20mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/L FeCl3溶液,终点到来时,用去了30mL的FeCl3溶液。⑴滴定终点的现象是____________________________________。[来
⑵原钛液的物质的量浓度为 。
⑶若在滴定终点读取滴定管刻度时,俯视标准液液面,则使Ti(Ⅳ)的含量测定结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com