
����Ŀ�����ⶨ�Ҵ��ķ���ʽΪC2H6O�������л����ձ����ͬ���칹�����Ʋ��Ҵ��ṹ��������������֮һ����I��CH3CH2OH��II��CH3OCH3��Ϊ�ⶨ��ṹ��Ӧ�������ʵ������Խ��ж��ԡ�����ʵ�顣�ָ����Ҵ����ơ�ˮ����Ҫ����������ס��ҡ�����λͬѧֱ��������ͼ������װ�ý���ʵ�飬ȷ���Ҵ��Ľṹ��
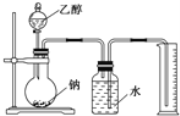
��1��ѧ���õ�һ��ʵ�����ݣ�
�Ҵ������ʵ�����mol�� | ������������������L�� |
0.10 | 1.13 |
0.10 | 1.11 |
0.10 | 1.12 |
0.10 | 1.18 |
������ϱ���������ͬѧ��ȷ����ʵ�����ݣ����������ƽ��ֵΪ__��L�����ɴ��ƶ��Ҵ��ĽṹӦΪ__ʽ����I��II��ʾ����������___��д���Ҵ����Ʒ�Ӧ�Ļ�ѧ����ʽ��___��
��2��ͬѧ�ҷֱ�ȷ����4.60g�Ҵ����ж��ʵ�飬����������ŵ���Ͳ�ڵ�ˮ���������Ϊ���ɵ�H2�������С��1.12L������ɱ�״�������������Ͳ������������ɵ�����ô����Ϊ������������Ʒ�к�������ˮ��ɵģ�����Ϊ��ȷ��___��������ȷ����������ȷ�������������ȷ����˵�����ɣ�____��
��3��ͬѧ����Ϊʵ��ɹ��Ĺؼ��У���װ��������Ҫ������ʵ�鿪ʼǰȷȷ���Ҵ������������������ƿ�ڱ���������ˮ����������IJ��㷽����ȷ����ֵȷ��Ӧ�˽�ʵ��ʱ���¶Ⱥʹ���ѹǿ��������ȷ����____��������ţ�
���𰸡�1.12 �� �õ�H2�����˵���Ҵ���������һ��H���������H��ͬ���Ӷ�ȷ���Ҵ����ӵĽṹ�� 2Na+CH3CH2OH=CH3CH2ONa+H2�� ����ȷ �õ�H2�����˵���Ҵ���������һ��H���������H��ͬ���Ӷ�ȷ���Ҵ����ӵĽṹ�� �� �� �� �� ��
��������
(1)ʵ�����ݱ���������������ƫ��Ӧ��ȥ����������ƽ�����Ϊ��![]() L=1.12L����ô1molC2H6O���������Ʒ�Ӧ�� ����11.2L������£�H2����0.5molH2��Ҳ����1molH��˵��1��C2H6O������ֻ��1����ԭ�ӱ�Na�û�����Ӧ����ʽΪ��2Na+CH3CH2OH=CH3CH2ONa+H2�����ʽṹʽΪ������Ǣ�
L=1.12L����ô1molC2H6O���������Ʒ�Ӧ�� ����11.2L������£�H2����0.5molH2��Ҳ����1molH��˵��1��C2H6O������ֻ��1����ԭ�ӱ�Na�û�����Ӧ����ʽΪ��2Na+CH3CH2OH=CH3CH2ONa+H2�����ʽṹʽΪ������Ǣ�
�ʴ�Ϊ��1.12���õ�H2�����˵���Ҵ���������һ��H���������H��ͬ���Ӷ�ȷ���Ҵ����ӵĽṹ��2Na+CH3CH2OH=CH3CH2ONa+H2����
(2)��ͬѧ��Ϊ��Ʒ�к�����ˮ�Ǵ���ģ���Ϊ2Na+2H2O�T2NaOH+H2������������ˮ�����������ȵ��������Ҵ��࣬Ӧ����1.12L��������ԭ���ǹ��ƿ����Ͳ֮�䲣��������ˮ�������û�������ڣ�
��Ϊ������ȷ�����ƿ����Ͳ֮�䲣��������ˮ�������û�������ڣ�
(3)ͬѧ������ʵ��ɹ��Ĺؼ��������У�ֻ�Т��Dz���Ҫ�ģ���Ϊ��Ӧ����ƿ�͵����ж����ڿ���������Ӱ��ʵ���ȷ�ԣ�
�ʴ�Ϊ���� �� �� �� �ޡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������벻����ѧ���磺����������Ƭ��������ƶѪ(��ͼ����˵����)���ڸ�������������������θ����࣬������������ˮ�����ȵȡ�

�Ķ��Ϸ�����������Ƭ���ı�ǩ˵�����ش�
��1�����������У�����ϡ����1������������___�����Ǽ�ϡ�����ԭ����_____��
��2������������������θ�����ʱ������������Ϊ___���������������������к���θ���������Ҳ�ܸ��ռ���Һ��Ӧ����Ӧ�����ӷ���ʽΪ_____��
��3�������ܾ�ˮ����Ϊ��Al3+��ˮ�⣬��ˮ�����������������____������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҽ�ˮ�����㹻ǿ�ĵ糡�У��� 20��ʱˮ����˲�����̿��γ���ů������ij��ȤС������ͼ��ʾʵ�飬�����ձ������� KMnO4 ��Һ��ɫ���������ݲ����������� KMnO4 ��Һ����FeCl3 ��Һ���ձ�����Һ��ɫ�ޱ仯���������ݲ�����������˵������ȷ����

A. 20 ��ʱ��ˮ�����γɵ���ů�����������ı仯�ǻ�ѧ�仯
B. ��ů������ˮ�����㹻ǿ�ĵ糡���γɵĻ����
C. �ձ���Һ��ΪFeCl3 ��Һʱ������������ΪCl2
D. ��������H2 ȼ�յIJ����п��ܺ���һ������H2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ļ���������ɴ�����Ⱦ����Ҫ���ʣ��о��йط�Ӧ������������������Ⱦ����Ҫ���塣
(1)NO�ڿ����д������·�Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��H��������Ӧ��������ɣ��䷴Ӧ������ͼ��ʾ���ش��������⣺
2NO2(g)��H��������Ӧ��������ɣ��䷴Ӧ������ͼ��ʾ���ش��������⣺
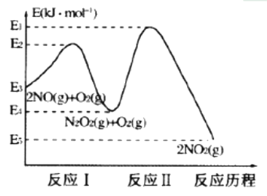
��д����ӦI���Ȼ�ѧ����ʽ______________��
�������¶ȷ����ܷ�Ӧ2NO(g)+O2(g)![]() 2NO2(g)�����ʷ��������������ͼ�ж�����˵������ȷ����_______(��Ӧδʹ�ô���)��
2NO2(g)�����ʷ��������������ͼ�ж�����˵������ȷ����_______(��Ӧδʹ�ô���)��
A ��ӦI�ǿ췴Ӧ����ӦII������Ӧ B �ܷ�Ӧ�������ɷ�ӦI����
C �����¶�ƽ��I��II�����淴Ӧ�����ƶ� D ���ڷ�ӦII��Ũ�ȵ�Ӱ������¶ȵ�Ӱ��
(2)�ý�̿��ԭNO2�ķ�ӦΪ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
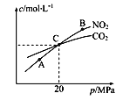
��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A)___Kc(B)(����<����>������=��)
��A��B��C������NO2��ת������͵���___(����A����B������C��)�㡣
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=_______(Kp����ƽ���ѹ����ƽ��Ũ�ȼ���)
(3)һ�������£���һ��Ũ��NOx(NO2��NO�Ļ������)ͨ��0.05 mol��L1��Ca(OH)2����Һ�У������ķ�ӦΪ��3NO2 + 2OH��= NO +2NO3-+ H2O��NO + NO2 +2OH��= 2NO2- + H2O���ı�![]() ��NOx��ȥ������ͼ��ʾ��
��NOx��ȥ������ͼ��ʾ��
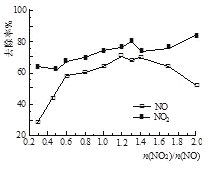 ��
��
��![]() �ĺ��ʷ�Χ��____��
�ĺ��ʷ�Χ��____��
�ڵ�![]() ����1.4ʱ��NO2ȥ��Ч�����ߣ���NOȥ��Ч��ȴ���͡�����ܵ�ԭ����____ ��
����1.4ʱ��NO2ȥ��Ч�����ߣ���NOȥ��Ч��ȴ���͡�����ܵ�ԭ����____ ��
��O3��NO��������Ҫ��ӦΪ��NO + O3 = NO2 + O2������NO�ij�ʼŨ�Ȳ��䣬�ı�![]() ������Ӧ��Ļ������ͨ��0.05mol��L1Ca(OH)2����Һ�����ա�Ϊ��ʡO3�����������ܱ���NOxȥ��Ч������
������Ӧ��Ļ������ͨ��0.05mol��L1Ca(OH)2����Һ�����ա�Ϊ��ʡO3�����������ܱ���NOxȥ��Ч������![]() ���ʵ�ֵԼΪ_________��
���ʵ�ֵԼΪ_________��
a 0.6 b 0.8 c 1.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��֪C��H2��CO��ȼ���ȵ����������ʾ��
���� | C | H2 | CO |
��H/kJ��mol��1 | ��393.5 | ��285.8 | ��283.0 |
��1��д��C��ȫȼ�յ��Ȼ�ѧ����ʽ��_____��
��2���ܱ�ʾH2ȼ���ȵ��Ȼ�ѧ����ʽΪ____��
��3������H2��COΪȼ�����ṩ���ܣ������ܵĽǶȿ��ǣ�����Ϊ���ѡ��__(��д���)��
A��H2 B��CO C��������
������___��
����֪�����Ȼ�ѧ����ʽ��
��H2O(l)=H2(g)��![]() O2(g) ��H����285.8 kJ/mol
O2(g) ��H����285.8 kJ/mol
��H2(g)��![]() O2(g)=H2O(g) ��H����241.8 kJ/mol
O2(g)=H2O(g) ��H����241.8 kJ/mol
��NaOH(aq)��HCl(aq)=NaCl(aq)��H2O(l) ��H����57.3 kJ/mol
�ش��������⣺
��4��������Ӧ���������ȷ�Ӧ����___(�����)��
��5��ȼ��10gH2����Һ̬ˮ���ų�������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˼ά�ǻ�ѧ�����г��õ�һ��˼ά�����������йط�Ӧ����ʽ�������ӷ���ʽ����������ȷ���ǣ�������
��֪ | ���� | |
A | ��Fe����CuSO4��Һ�У� Fe + Cu2+ = Cu + Fe2+ | ��Na���뵽CuSO4��Һ�У� 2Na + Cu2+ = Cu + 2Na+ |
B | ϡ������Ba(OH)2��Һ��Ӧ����Һ�����ԣ� 2H++SO42��+Ba2++2OH��=BaSO4��+2H2O | NaHSO4��Һ��Ba(OH)2��Һ��Ӧ�����ԣ� 2H++SO42��+Ba++2OH��=BaSO4��+2H2O |
C | ����������Ӧ2Fe+3Cl2 | ���͵��ʷ�Ӧ2Fe+3I2 |
D | ��Ca��ClO��2��Һ��ͨ������CO2�� Ca2++2ClO��+CO2+H2O=CaCO3��+2HClO | ��Ca��ClO��2��Һ��ͨ������SO2�� Ca2++2ClO��+SO2+H2O=CaSO3��+2HClO |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20ml1mol/L��AlCl3��Һ�еμ�0.2mol/L��NaOH��Һ�������1.17�˳������ɣ������NaOH��Һ�������
A.125mLB.275mLC.325mLD.450mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͬ���칹���������ȷ����
A.C4H10�Ķ��ȴ�����8��
B.�ױ���������ּӳɺ�IJ����һ�������4��
C.����ʽΪC10H12O2�ķ��㻯�������������ұ��������ĸ�ȡ��������6��
D.����ʽΪC5H10����ʹ������Ȼ�̼��Һ��ɫ���л���(���������칹)��6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Դ��Ϊ�����о��ȵ㡣CH3NH2��PbI2��HI�������ϳ�̫���ܵ�ص��������װ�Ǧ��(CH3NH3PbI3)����Ҫԭ�ϡ�
��1����ȡ�װ��ķ�ӦΪCH3OH(g)��NH3(g)![]() CH3NH2(g)��H2O(g) ��H����֪�÷�Ӧ����ػ�ѧ���ļ����������£�
CH3NH2(g)��H2O(g) ��H����֪�÷�Ӧ����ػ�ѧ���ļ����������£�
���ۼ� | C-O | H-O | N-H | C-N |
����/kJ��mol-1 | E1 | E2 | E3 | E4 |
�������Ȼ�ѧ����ʽ����H=___kJ��mol-1��
��2��������ˮú���ϳ�������Ӧ����״�����ӦΪCO(g)��2H2(g)![]() CH3OH(g)��H��0����һ�������£���1molCO��2molH2ͨ���ܱ������н��з�Ӧ�����ı�ijһ�������(�¶Ȼ�ѹǿ)ʱ��CH3OH�����������(CH3OH)�仯������ͼ��ʾ��
CH3OH(g)��H��0����һ�������£���1molCO��2molH2ͨ���ܱ������н��з�Ӧ�����ı�ijһ�������(�¶Ȼ�ѹǿ)ʱ��CH3OH�����������(CH3OH)�仯������ͼ��ʾ��
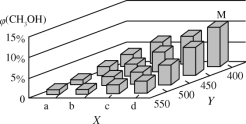
��ƽ��ʱ��M��CH3OH���������Ϊ10%����CO��ת����Ϊ___��
��ͼ��Y���ʾ�¶ȣ����жϵ�������__��
��3����������������Ǧ������ᷴӦ�Ʊ�����PbI2������Ӧ������amolPbI2����ת�Ƶ��ӵ����ʵ���Ϊ___��
��4������������ͨ���ˮ�Ʊ�HI�ķ�Ӧ������ͼ��ʾ���䷴Ӧԭ��Ϊ��SO2��I2��2H2O=3H����HSO4-��2I-��I2��I-![]() I3-��ͼ������a��b�ֱ����������__��__���������ţ�����ͼ֪Ҫ��ߵ�Ļ�ԭ�ʣ��������¶��⣬�����Բ�ȡ�Ĵ�ʩ��___��
I3-��ͼ������a��b�ֱ����������__��__���������ţ�����ͼ֪Ҫ��ߵ�Ļ�ԭ�ʣ��������¶��⣬�����Բ�ȡ�Ĵ�ʩ��___��
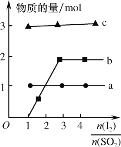
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com