
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
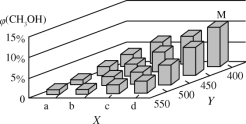
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
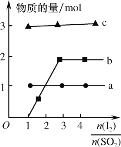
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
【答案】(E1+E3)-(E2+E4) 25% 随着Y值增加φ(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)逆移
CH3OH(g)逆移 ![]() amol HSO4- I3- 减小
amol HSO4- I3- 减小![]() 的投料比
的投料比
【解析】
(1)反应热=反应物总键能-生成物总键能;
(2)①依据题意建立三段式求解可得;
②该反应为放热反应,升高温度,平衡向逆反应方向移动;
(3)四氧化三铅和氢碘酸发生氧化还原反应制备生成PbI2、I2和H2O,反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O;
(4)根据图象b为从零越来越大的离子,a为不变的离子,结合反应过程分析判断;减小![]() 的投料比能提高碘的还原率。
的投料比能提高碘的还原率。
(1)反应热=反应物总键能-生成物总键能,由题给键能数据可知△H=(E1+E3)-(E2+E4),故答案为:(E1+E3)-(E2+E4);
(2)①设CO的转化率为x,由题意建立如下三段式:
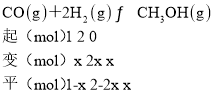
由平衡时CH3OH的体积分数为10%可得![]() ×100%=10%,x=0.25即25%,故答案为:25%;
×100%=10%,x=0.25即25%,故答案为:25%;
②该反应为放热反应,升高温度,平衡向逆反应方向移动,由图可知,随着Y值的增加,CH3OH的体积分数φ(CH3OH)减小,说明平衡向逆反应方向移动,则Y表示温度,故答案为:随着Y值增加φ(CH3OH)减小,平衡CO(g)+2H2(g)![]() CH3OH(g)逆移;
CH3OH(g)逆移;
(3)四氧化三铅中铅元素的化合价为+![]() 价,碘化铅中铅元素的化合价为+2价,铅元素化合价降低,反应中四氧化三铅作氧化剂,HI作还原剂,碘元素化合价-1价变化为0价,生成I2,则四氧化三铅和氢碘酸发生氧化还原反应生成PbI2、I2和H2O,反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O,由方程式可知每生成3molPbI2的反应中电子转移2mol,则生成amolPbI2转移电子的物质的量为
价,碘化铅中铅元素的化合价为+2价,铅元素化合价降低,反应中四氧化三铅作氧化剂,HI作还原剂,碘元素化合价-1价变化为0价,生成I2,则四氧化三铅和氢碘酸发生氧化还原反应生成PbI2、I2和H2O,反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O,由方程式可知每生成3molPbI2的反应中电子转移2mol,则生成amolPbI2转移电子的物质的量为![]() amol,故答案为:
amol,故答案为:![]() amol;
amol;
(4)由图象可知,b为从零越来越大的离子,结合反应原理为SO2+I2+2H2O=3H++HSO4-+2I-和I2+I-![]() I3-可知反应中越来越多的离子为I3-,反应过程中氢离子和硫酸氢根离子始终不变,但氢离子的物质的量是硫酸氢根的3倍,则图中曲线a、b分别代表的微粒是HSO4-、I3-;由图可知,要提高碘的还原率,除控制温度外,还可以采取的措施是减小
I3-可知反应中越来越多的离子为I3-,反应过程中氢离子和硫酸氢根离子始终不变,但氢离子的物质的量是硫酸氢根的3倍,则图中曲线a、b分别代表的微粒是HSO4-、I3-;由图可知,要提高碘的还原率,除控制温度外,还可以采取的措施是减小![]() 的投料比,故答案为:HSO4-;I3-;减小
的投料比,故答案为:HSO4-;I3-;减小![]() 的投料比。
的投料比。


科目:高中化学 来源: 题型:
【题目】经测定乙醇的分子式为C2H6O。由于有机物普遍存在同分异构现象,推测乙醇结构可能是下列两种之一:(I)CH3CH2OH(II)CH3OCH3。为测定其结构,应利用物质的特殊性进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,请甲、乙、丙三位同学直接利用如图给定的装置进行实验,确定乙醇的结构。
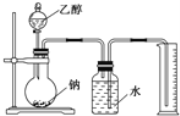
(1)学生甲得到一组实验数据:
乙醇的物质的量(mol) | 氢气的体积(标况)(L) |
0.10 | 1.13 |
0.10 | 1.11 |
0.10 | 1.12 |
0.10 | 1.18 |
请根据上表,帮助甲同学正确处理实验数据,氢气体积的平均值为__(L),由此推断乙醇的结构应为__式(用I或II表示),理由是___。写出乙醇与钠反应的化学方程式:___。
(2)同学乙分别准确称量4.60g乙醇进行多次实验,结果发现以排到量筒内的水的体积,作为生成的H2体积总是小于1.12L(换算成标准状况后)。如果忽略量筒本身及读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?___(填“正确”或“不正确”)。如果不正确,请说明理由:____。
(3)同学丙认为实验成功的关键有:①装置气密性要良好②实验开始前准确确定乙醇的量③钠足量④广口瓶内必须有足量水⑤氢气体积的测算方法正确、数值准确⑥应了解实验时的温度和大气压强。其中正确的有____。(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
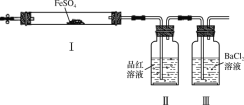
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镓有“电子工业脊梁”的美誉,镓及其化合物应用广泛。
(1)一种镍催化法生产GaN的工艺如图:
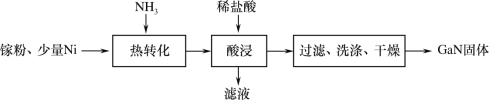
①镓(Ga)的原子结构示意图为![]() ,镓元素在周期表中的位置是___。
,镓元素在周期表中的位置是___。
②“热转化”时Ga转化为GaN的化学方程式是___。
③“酸浸”操作目的是___。
(2)某学校化学兴趣小组在实验室利用如图装置模拟制备氮化镓:
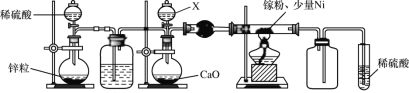
①仪器X中的试剂是__,加热前需先通入一段时间的H2,原因是__。
②取某GaN样品m克溶于足量热NaOH溶液,发生反应GaN+OH﹣+H2O![]() GaO2-+NH3↑,用H3BO3溶液将产生
GaO2-+NH3↑,用H3BO3溶液将产生![]() NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
NH3完全吸收,滴定吸收液时消耗浓度为cmol/L的盐酸VmL,则样品的纯度是___。
已知:NH3+H3BO3=NH3H3BO3;NH3H3BO3+HCl=NH4Cl+H3BO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含OH-、SO42-、HCO3-、Cl-、Ba2+和Na+。探究小组为了确定该溶液中离子的组成,取该溶液100mL进行以下实验:
(1)填写下表空格
实验操作与现象 | 实验结论 | 判断理由 | |
步骤一 | 加入过量HCl溶液,有气泡产生; | 肯定有___、肯定无___。 | HCO3-与OH-不共存 |
步骤二 | 步骤一中得到标况下的气体22.4L; | HCO3-的物质的量浓度为___mol/L | C元素守恒 |
步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,经过滤得到46.6g不溶于稀硝酸的沉淀。 | 肯定有___、___;肯定无___。 | 溶液显电中性;SO42-与Ba2+不共存会产生白色沉淀。 |
(2)步骤三过滤所需玻璃仪器有:烧杯、___、___。
(3)步骤一产生气泡的离子方程式为___,步骤三生成沉淀的离子方程式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该试剂的物质的量浓度为9.2 mol·L-1
B.该硫酸50 mL与足量的铜反应可得到标准状况下0.46 mol气体
C.配制200 mL 4.6mol·L-1的稀硫酸需取该硫酸50 mL
D.该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸和乙醇反应制取乙酸乙酯的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上。回答下列问题:
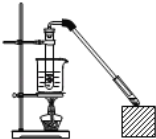
(1)乙酸的官能团是____(写名称)。制取乙酸乙酯的化学方程式为:___。
(2)①浓H2SO4的作用是____。
②小试管中的溶液是____,其作用是____(写出一种即可);
③长导管不插入液面以下的目的是____;
(4)实验中采取的加热方式称,这种加热方式的好处主要有____、___;
(5)反应生成的乙酸乙酯,其密度比水___(填“大”或“小”),有___气味。应从该分液漏斗的___(填编号,多填、少填均不得分)。
a.下部流出 b.上口倒出 c.都可以
(6)若实验室中温度过高,温度达170℃,副产物中主要有机产物是___(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量混合气体在密封容器中发生如下反应:xA(g)+yB(g)![]() nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
nC(g)。达到平衡后测得A气体的浓度为0.5mol/L;保持恒温下将密闭容器的容积扩大1倍,再达到平衡时,测得A的浓度为0.3 mol/L。则下列叙述正确的是
A.x+y<nB.该化学平衡向右移动
C.B的转化率增大D.A的物质的量增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com