
【题目】实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
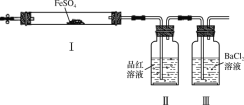
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】氮的化合物是造成大气污染的主要物质,研究有关反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
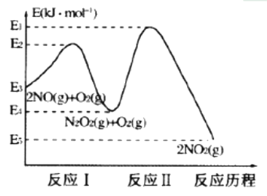
①写出反应I的热化学方程式______________。
②升高温度发现总反应2NO(g)+O2(g)![]() 2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有_______(反应未使用催化剂)。
2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有_______(反应未使用催化剂)。
A 反应I是快反应,反应II是慢反应 B 总反应的速率由反应I决定
C 升高温度平衡I、II均向逆反应方向移动 D 对于反应II,浓度的影响大于温度的影响
(2)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
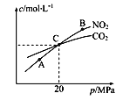
①A、B两点的浓度平衡常数关系:Kc(A)___Kc(B)(填“<”“>”或“=”)
②A、B、C三点中NO2的转化率最低的是___(填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=_______(Kp是用平衡分压代替平衡浓度计算)
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变![]() ,NOx的去除率如图所示:
,NOx的去除率如图所示:
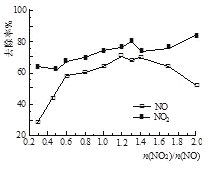 。
。
①![]() 的合适范围是____。
的合适范围是____。
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是____ 。
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是____ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变![]() ,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则![]() 合适的值约为_________。
合适的值约为_________。
a 0.6 b 0.8 c 1.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A.C4H10的二氯代物有8种
B.甲苯与氢气充分加成后的产物的一溴代物有4种
C.分子式为C10H12O2的芳香化合物属于酯类且苯环上有四个取代基的有6种
D.分子式为C5H10并能使溴的四氯化碳溶液褪色的有机物(不含立体异构)有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.1000mol·L-1NaOH溶液分别滴定20.00ml0.1000mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )

A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COOH)>c(CH3COO-)
C.pH=7时,滴定盐酸消耗V(NaOH)大于醋酸消耗V(NaOH)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)═c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种化合物,均含有常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
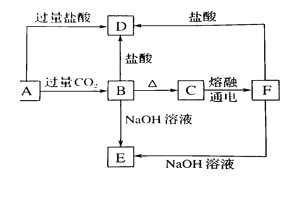
(1)写出化学式;
A______ ,C______ ,D______ ,E______
(2)写出下列反应的离子方程式:
①A→B: _____________________________________________
②B→E: _____________________________________________
③C→E: _____________________________________________
④F→E: _____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理利用资源成为当今研究热点。CH3NH2、PbI2及HI常用作合成太阳能电池的敏化剂甲胺铅碘(CH3NH3PbI3)的主要原料。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | E1 | E2 | E3 | E4 |
则上述热化学方程式中ΔH=___kJ·mol-1。
(2)可利用水煤气合成上述反应所需甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g)ΔH<0。在一定条件下,将1molCO和2molH2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
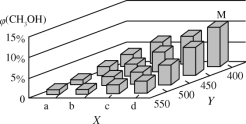
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为___。
②图中Y轴表示温度,其判断的理由是__。
(3)可利用四氧化三铅和氢碘酸反应制备难溶PbI2,若反应中生成amolPbI2,则转移电子的物质的量为___。
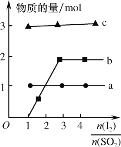
(4)将二氧化硫通入碘水制备HI的反应曲线如图所示,其反应原理为:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
I3-,图中曲线a、b分别代表的微粒是__和__(填微粒符号);由图知要提高碘的还原率,除控制温度外,还可以采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M的结构如图所示,X、Y、Z、W是原子序数依次增大的短周期主族元素,其中W的核外电子数是Y的两倍。下列说法正确的是( )
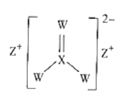
A.简单离子的半径:W>Z>Y
B.最简单氢化物的沸点:W>X>Y
C.Y、W均能和Z形成两种化合物
D.W的单质不能溶于XW2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯乙烷跟相关有机化合物之间的转化如下图所示:
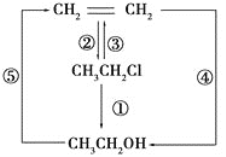
(1)写出各反应的化学方程式
①__________________________________________________,
②__________________________________________________,
③__________________________________________________,
④_________________________________________________,
⑤_______________________________________________。
(2)根据上述方程式回答下列问题:
A.上述化学反应的反应类型有____________________________。
B.证明CH3CH2Cl属于卤代烃的操作方法是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com